Labor- und Mikrobiologiebefund (Version 3.0.0)
|
|
Diese Seite oder Abschnitt ist derzeit ein Entwurf und kann sich noch ändern. This article was last edited by Kleinoscheg (talk| contribs) 4 years ago. This article or section is in the middle of an expansion or major restructuring. This article was last edited by Kleinoscheg (talk| contribs) 4 years ago. |
|
|
Dieses Dokument gibt wieder:
Implementierungsleitfaden Labor- und Mikrobiologiebefund (3.0.0), OID: 1.2.40.0.34.7.4.7, Datum: 2021.xx.xx, Status: Normativ. Die Teilmaterialien gehören der Kategorie ILF an. |
Implementierungsleitfäden
Labor- und Mikrobiologiebefund
Gesundheitswesen [1.2.40.0.34.7.4.7]
Inhaltsverzeichnis
- 1 Zusammenfassung
- 2 Informationen über dieses Dokument
- 3 Einleitung
- 4 Leitfadenerstellungs- und Harmonisierungsprozess
- 5 Technischer Hintergrund
- 6 Vorgaben zum medizinischen Inhalt
- 7 Funktionale Anforderungen
- 8 Konformitätsprüfung
- 9 Anwendungsfälle
- 9.1 Anwendungsfall LAB01: "Laboruntersuchung eines niedergelassenen Labors"
- 9.2 Anwendungsfall LAB02: "Laboruntersuchung im Rahmen eines stationären Aufenthalts in einem Spital"
- 9.3 Anwendungsfall LAB03: "Teilweise externe Vergabe von Laboruntersuchungen"
- 9.4 Anwendungsfall LAB04: "Update von Laborbefunden"
- 10 Dataset des Labor- und Mikrobiologiebefunds
- 11 Technische Spezifikation
- 12 Anhang
Dieses Dokument bildet den vollständigen Implementierungsleitfaden des Labor- und Mikrobiologiebefundes ab und richtet sich an Softwareentwickler und Berater. Zum besseren Verständnis empfehlen wir Ihnen, den zusammenfassenden Guide im Vorfeld zu lesen.
1 Zusammenfassung
Der Implementierungsleitfaden "Labor- und Mikrobiologiebefund" beschreibt die Inhalte, die für den Austausch von fertiggestellten, und fachärztlich vidierten Befunden innerhalb und zwischen Einrichtungen des österreichischen Gesundheitswesens, notwendig sind.
Der Leitfaden enthält Festlegungen, Einschränkungen und Bedingungen auf Grundlage des internationalen Standards ISO/HL7 27932:2009 HL7 Clinical Document Architecture, Release 2.0 (CDA) und ist ein nationaler Standard der HL7 Austria.
Die Grundlage der Datenaustauschformate ist der internationale CDA-Standard, der sich in ELGA bewährt hat. Er erlaubt es Sender und Empfänger, sich ohne vorherige Absprache zu verstehen. Der Standard hat zum Ziel, einen umfassenden Austausch von semantisch interoperablen Informationen zwischen allen beteiligten Akteuren bei der Behandlung von Patienten zu ermöglichen. Der Datenaustausch findet hierbei nicht nur innerhalb einer Einrichtung, sondern auch zwischen kooperierenden Einrichtungen und über Sektorengrenzen hinaus statt. Die Empfänger der Dokumente sollen die Inhalte benutzen und weiterverwenden können, ohne sich vorher mit dem Ersteller absprechen zu müssen.
TODO: Standard XDLAB, FullSupport, status active/completed
Der "Labor- und Mikrobiologiebefund" basiert auf den Vorgaben des Allgemeinen Implementierungsleitfadens. Darin werden die notwendigen Datentypen, Dokument-Metadaten (Header), die Möglichkeiten der Textstrukturierung, grundlegende Vorgaben für die Anwendung von Terminologien, einige allgemein genutzten Inhaltsstrukturen (Sections) sowie Codebeispiele und praktische Implementierungshilfen gezeigt. Alle weiteren, für diesen Leitfaden benötigten Elemente werden hier erklärt. Die Notation der Spezifikation der Datenaustauschformate folgt der "Art-Decor"-Schreibweise, die auf einer eigenen Seite (Art-Decor-Tabellen verstehen) erläutert wird.
Der vorgesehene Ablauf des Datenaustausches wird im Kapitel Anwendungsfälle beschrieben.
Übersichtstabellen für Header und Body-Strukturen
- Übersichtstabelle der CDA Strukturen des Headers (administrative Daten)
- Übersichtstabelle der CDA Strukturen des Bodys (medizinische Inhalte)
Auf der Diskussionsseite werden die Fehler und Änderungswünsche an dieser Version dokumentiert.
2 Informationen über dieses Dokument
2.1 Impressum
Medieneigentümer, Herausgeber, Hersteller, Verleger:
ELGA GmbH, Treustraße 35-43, Wien, Österreich. Telefon: +43.1.2127050
Internet: www.elga.gv.at
Email: cda@elga.gv.at
Geschäftsführer: DI Dr. Günter Rauchegger, DI(FH) Dr. Franz Leisch
Redaktion, Projektleitung, Koordination:
Mag.Dr. Stefan Sabutsch, stefan.sabutsch@elga.gv.at
Abbildungen: © ELGA GmbH
Nutzung: Das Dokument enthält geistiges Eigentum der Health Level Seven® Int. und HL7® Austria, Franckstrasse 41/5/14, 8010 Graz; www.hl7.at.
Die Nutzung ist ohne Lizenz- und Nutzungsgebühren zum Zweck der Erstellung medizinischer Dokumente ausdrücklich erlaubt. Andere Arten der Nutzung und auch auszugsweise Wiedergabe bedürfen der Genehmigung des Medieneigentümers.
Download unter www.gesundheit.gv.at und www.elga.gv.at/cda
2.2 Haftungsausschluss
Die Arbeiten für den vorliegenden Leitfaden wurden von den Autoren gemäß dem Stand der Technik und mit größtmöglicher Sorgfalt erbracht und über ein öffentliches Kommentierungsverfahren kontrolliert. Die Nutzung des vorliegenden Leitfadens erfolgt in ausschließlicher Verantwortung der Anwender. Aus der Verwendung des vorliegenden Leitfadens können keinerlei Rechtsansprüche gegen die Autoren, Herausgeber oder Mitwirkenden erhoben und/oder abgeleitet werden. Ein allfälliger Widerspruch zum geltenden Recht ist jedenfalls nicht beabsichtigt und von den Erstellern des Dokumentes nicht gewünscht.
2.3 Sprachliche Gleichbehandlung
Soweit im Text Bezeichnungen nur im generischen Maskulinum angeführt sind, beziehen sie sich auf Männer, Frauen und andere Geschlechtsidentitäten in gleicher Weise. Unter dem Begriff "Patient" werden sowohl Bürger, Kunden und Klienten zusammengefasst, welche an einem Behandlungs- oder Pflegeprozess teilnehmen als auch gesunde Bürger, die derzeit nicht an einem solchen teilnehmen. Es wird ebenso darauf hingewiesen, dass umgekehrt der Begriff Bürger auch Patienten, Kunden und Klienten mit einbezieht.
2.4 Lizenzinformationen
Die von HL7 Austria erarbeiteten Standards und die Bearbeitungen der Standards von HL7 International stellen Werke im Sinne des österreichischen Urheberrechtsgesetzes dar und unterliegen daher urheberrechtlichem Schutz.
HL7 Austria genehmigt die Verwendung dieser Standards für die Zwecke der Erstellung, des Verkaufs und des Betriebs von Computerprogrammen, sofern nicht anders angegeben oder sich die Standards auf andere urheberrechtlich oder lizenzrechtlich geschützte Werke beziehen.
Die vollständige oder teilweise Veröffentlichung der Standards (zum Beispiel in Spezifikationen, Publikationen oder Schulungsunterlagen) ist nur mit einer ausdrücklichen Genehmigung der HL7 Austria gestattet. Mitglieder von HL7 Austria sind berechtigt, die Standards vollständig oder in Auszügen ausschließlich organisationsintern zu publizieren, zu vervielfältigen oder zu verteilen. Die Veröffentlichung eigener Anpassungen der HL7-Spezifikationen (im Sinne von Lokalisierungen) oder eigener Leitfäden erfordert eine formale Vereinbarung mit der HL7 Austria.
HL7® und CDA® sind die eingetragenen Marken von Health Level Seven International. Die vollständigen Lizenzinformationen finden sich unter https://hl7.at/nutzungsbedingungen-und-lizenzinformationen/. Die Lizenzbedingungen von HL7 International finden sich unter http://www.HL7.org/legal/ippolicy.cfm
2.4.1 Urheber- und Nutzungsrechte von anderen Quellen ("Third Party IP")
Third Party Intellectual Property
Der Nutzer dieses Dokuments (bzw. der Lizenznehmer) stimmt zu und erkennt an, dass HL7 Austria nicht alle Rechte und Ansprüche in und an den Materialien besitzt und dass die Materialien geistiges Eigentum von Dritten enthalten und / oder darauf verweisen können ("Third Party Intellectual Property (IP)").
Die Anerkennung dieser Lizenzbestimmungen gewährt dem Lizenznehmer keine Rechte in Bezug auf Third Party IP. Der Lizenznehmer allein ist für die Identifizierung und den Erhalt von notwendigen Lizenzen oder Genehmigungen zur Nutzung von Third Party IP im Zusammenhang mit den Materialien oder anderweitig verantwortlich.
Jegliche Handlungen, Ansprüche oder Klagen eines Dritten, die sich aus einer Verletzung eines Third Party IP-Rechts durch den Lizenznehmer ergeben, bleiben die Haftung des Lizenznehmers.
2.4.2 SNOMED CT
Dieser Leitfaden enthält Material, das durch SNOMED International urheberrechtlich geschützt ist. Jede Verwendung von SNOMED CT in Österreich erfordert eine aufrechte Affiliate Lizenz oder eine Sublizenz. Die entsprechende Lizenz ist kostenlos, vorausgesetzt die Verwendung findet nur in Österreich statt und erfüllt die Bedingungen des Affiliate License Agreements. Affiliate Lizenzen können über das Member Licensing and Distribution Service (MLDS) direkt beim jeweiligen NRC beantragt werden: MLDS für Österreich.
2.4.3 Weitere Terminologien
Im Folgenden finden Sie eine nicht-exhaustive Liste von weiteren Terminologien, die eine solche separate Lizenz erfordern können:
| Terminologie | Eigentümer, Kontaktinformation |
|---|---|
| Logical Observation Identifiers Names & Codes (LOINC) [1] | Regenstrief Institute, Inc. [2] |
| Unified Code for Units of Measure (UCUM) [3] | Regenstrief Institute, Inc. [2] |
| International Classification of Diseases (ICD) [4] | World Health Organization (WHO) [5] |
| ICD-10 BM*G*[6] | Für Gesundheit zuständiges Bundesministerium www.sozialministerium.at |
| Anatomical Therapeutic Chemical Classification System (ATC) [7] | World Health Organization (WHO)[5] |
| Pharmazentralnummer (PZN) | ARGE Pharma im Fachverband der chemischen Industrie Österreichs (FCIO) der Wirtschaftskammern Österreichs (WKO) [8] |
| EDQM-Codes | Europäisches Direktorat für die Qualität von Arzneimitteln [9] |
| Medical Device Communications (MDC) vom ISO/IEEE 11073 Standard | MDC wird als Substandard 10101 "Nomenclature" in "Health informatics - Medical / health device communication standards", kurz 11073, geführt und werden mit einem Copyright bei IEEE SA am österreichischen Termserver bereitgestellt. [10], [11] |
Die Terminologien werden am österreichischen Terminologieserver zur Verfügung gestellt.
2.5 Verwendete Grundlagen und Bezug zu anderen Standards
Grundlage dieses Implementierungsleitfadens ist der internationale Standard "HL7 Clinical Document Architecture, Release 2.0" (CDA ©), für die das Copyright © von Health Level Seven International[12] gilt. 2009 wurde die Release 2.0 als ISO-Standard ISO/HL7 27932:2009 publiziert[13].
CDA definiert die Struktur und Semantik von "medizinischen Dokumenten" zum Austausch zwischen Gesundheitsdiensteanbietern und Patienten. Es enthält alle Metadaten zur Weiterverarbeitung und einen lesbaren textuellen Inhalt und kann diese Informationen auch maschinenlesbar tragen. Das Datenmodell von CDA und seine Abbildung in XML[14] folgen dem Basisstandard HL7 Version 3[15] mit seinem Referenz-Informationsmodell (RIM). Dieser Leitfaden verwendet das HL7-Template-Austauschformat zur Definition der "Bausteine" (Templates) und ART-DECOR® [16] als Spezifikationsplattform.
- HL7 Clinical Document Architecture (CDA) [17]
- HL7 Referenz-Informationsmodell (RIM)[18]
- HL7 V3 Datentypen [19]
- HL7 Template-Austauschformat Specification and Use of Reusable Information Constraint Templates, Release 1[20]
Die HL7 Standards können über die HL7 Anwendergruppe Österreich (HL7 Austria)[21], die offizielle Vertretung von Health Level Seven International in Österreich bezogen werden (www.HL7.at). Alle auf nationale Verhältnisse angepassten und veröffentlichten HL7-Spezifikationen können ohne Lizenz- und Nutzungsgebühren in jeder Art von Anwendungssoftware verwendet werden.
2.6 Verbindlichkeit
Die Verbindlichkeit und die Umsetzungsfrist dieses Leitfadens sind im Gesundheitstelematikgesetz 2012, BGBl.I Nr.111/2012 sowie in den darauf fußenden ELGA-Verordnungen geregelt.
Der Leitfaden in seiner jeweils aktuell gültigen Fassung sowie die aktualisierten Terminologien sind vom zuständigen Minister auf www.gesundheit.gv.at zu veröffentlichen. Der Zeitplan zur Bereitstellung der Datenaustauschformate wird durch das Gesundheitstelematikgesetz 2012 und darauf basierenden Durchführungsverordnungen durch den zuständigen Bundesminister vorgegeben. Hauptversionen, also Aktualisierungen des Implementierungsleitfadens, welche zusätzliche verpflichtende Konformitätskriterien enthalten ("Mandatory" (M), "Required" (R) und "Fixed" (F)), sind mit ihren Fristen zur Bereitstellung per Verordnung kundzumachen. Andere Aktualisierungen (Nebenversionen) dürfen auch ohne Änderung dieser Verordnung unter www.gesundheit.gv.at veröffentlicht werden.
Die Anwendung dieses Implementierungsleitfadens hat im Einklang mit der Rechtsordnung der Republik Österreich und insbesondere mit den relevanten Materiengesetzen (z.B. Ärztegesetz 1998, Apothekenbetriebsordnung 2005, Krankenanstalten- und Kuranstaltengesetz, Gesundheits- und Krankenpflegegesetz, Rezeptpflichtgesetz, Datenschutzgesetz 2000, Gesundheitstelematikgesetz 2012) zu erfolgen. Technische Möglichkeiten können gesetzliche Bestimmungen selbstverständlich nicht verändern, vielmehr sind die technischen Möglichkeiten im Einklang mit den Gesetzen zu nutzen.
Die Einhaltung der gesetzlichen Bestimmungen liegt im Verantwortungsbereich der Ersteller der CDA-Dokumente.
2.7 Verwendete Grundlagen und Bezug zu anderen Standards
|
Grundlage dieses Implementierungsleitfadens ist der internationale Standard "HL7 Clinical Document Architecture, Release 2.0" (CDA ©), für die das Copyright © von Health Level Seven International[12] gilt. 2009 wurde die Release 2.0 als ISO-Standard ISO/HL7 27932:2009 publiziert[22]. CDA definiert die Struktur und Semantik von "medizinischen Dokumenten" zum Austausch zwischen Gesundheitsdiensteanbietern und Patienten. Es enthält alle Metadaten zur Weiterverarbeitung und einen lesbaren textuellen Inhalt und kann diese Informationen auch maschinenlesbar tragen. Das Datenmodell von CDA und seine Abbildung in XML[23] folgen dem Basisstandard HL7 Version 3[24] mit seinem Referenz-Informationsmodell (RIM). Dieser Leitfaden verwendet das HL7-Template-Austauschformat zur Definition der "Bausteine" (Templates) und ART-DECOR® [25] als Spezifikationsplattform.
Die HL7 Standards können über die HL7 Anwendergruppe Österreich (HL7 Austria)[26], die offizielle Vertretung von Health Level Seven International in Österreich bezogen werden (www.HL7.at). Alle auf nationale Verhältnisse angepassten und veröffentlichten HL7-Spezifikationen können ohne Lizenz- und Nutzungsgebühren in jeder Art von Anwendungssoftware verwendet werden.
Der Labor- und Mikrobiologiebefund basiert auf den Vorgaben des Allgemeinen Implementierungsleitfadens 2020.
Für die Modellierung der technischen Spezifikation diente IHE XD-LAB 2019-08 [TODO]. |
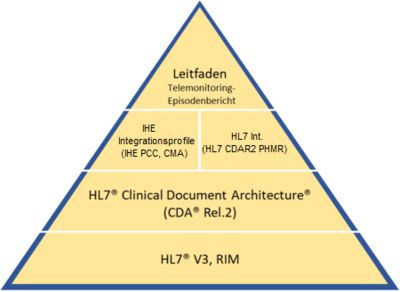
|
TODO: Grafik anpassen
2.8 Wichtige unterstützende Materialien
Auf der Website Labor- und Mikrobiologiebefund 2020 Guide werden unter anderem folgende Materialien zur Verfügung gestellt:
- die PDF-Version dieses Leitfadens
- Beispieldokumente
- ein erweitertes CDA-Schema
- Schematron-Prüfregeln
Die im weiteren angeführten Templatespezifikationen wurden im Art-Decor Projektrepository Labor- und Mikrobiologiebefund erstellt und können dort eingesehen werden.
Gemeinsam mit diesem Leitfaden werden auf der Website der ELGA GmbH (www.elga.gv.at/CDA) weitere Dateien und Dokumente zur Unterstützung bereitgestellt:
- Beispieldokumente
- Referenz-Stylesheet (Tool zur Darstellung im Browser - Konvertierung in HTML)
- CDA2PDF Suite (Tool zur Erzeugung einer PDF-Datei zur Ausgabe am Drucker)
- Schematron-Dateien für die Prüfung der Konformität ("Richtigkeit") von CDA Dateien
- Vorgaben zur Registrierung von CDA-Dokumenten (Leitfaden für XDS-Metadaten)
- Hinweise für die zu verwendenden Terminologien
- Leitfaden zur richtigen Verwendung von Terminologien
2.9 Bedienungshinweise
2.9.1 Farbliche Hervorhebungen und Hinweise
Themenbezogene Hinweise zur besonderen Beachtung:
Hinweis:
Es dürfen keine Elemente oder Attribute verwendet werden, die nicht vom allgemeinen oder einem speziellen ELGA-Implementierungsleitfaden definiert wurden
Hinweis auf anderen Implementierungsleitfaden:
Verweis
Verweis auf den Allgemeinen Leitfaden:…
Themenbezogenes CDA Beispiel-Fragment im XML Format:
<BEISPIEL> <languageCode code="de-AT" />
Nutzen Sie die bereitgestellten Links im Dokument (z.B. im Inhaltsverzeichnis), um direkt in der PDF-Version dieses Dokuments zu navigieren. Folgende Tastenkombinationen können Ihnen die Nutzung des Leitfadens erleichtern:
- Rücksprung: Alt + Pfeil links und Retour: Alt + Pfeil rechts
- Seitenweise blättern: "Bild" Tasten
- Scrollen: Pfeil nach oben bzw. unten
- Zoomen: Strg + Mouserad drehen
- Suchen im Dokument: Strg + F
3 Einleitung
3.1 Ausgangslage und Motivation
Die Elektronische Gesundheitsakte (ELGA) ermöglicht den vom ELGA-Gesetz berechtigten Personen, entsprechend ihren Rollen, den Zugriff auf relevante Gesundheitsdaten, die in bedarfsgerecht elektronisch aufbereiteter Form online zur Verfügung gestellt werden.
Die zentrale Anwendung von ELGA ist die Bereitstellung von medizinischen Dokumenten (e Befunde) der ELGA-Teilnehmer, die in vielen unterschiedlichen Informationssystemen der verschiedenen ELGA-Gesundheitsdiensteanbieter erstellt werden. Diese Dokumente sollen nicht nur von Benutzern gelesen, sondern auch wieder in die IT-Systeme integriert und dort weiterverwendet werden können ("Semantische Interoperabilität"). Beispielsweise können für den Arzt aus ELGA-Dokumenten automatisch Warnungen, Erinnerungen und Zusammenfassungen generiert und weitere Informationen berechnet sowie kontextbezogen angezeigt werden.
Um dieses Ziel zu erreichen, wird für Dokumente in ELGA der internationale Standard "Clinical Document Architecture, Release 2.0" (CDA) von HL7 eingesetzt.
Der CDA-Standard wird für die Verwendung in ELGA im Detail ausspezifiziert. Vorgaben für einheitliche Dokumentation und Codierung der Information werden festgelegt und in implementierbaren Leitfäden veröffentlicht.
3.2 Zweck des Dokuments
Das vorliegende Dokument enthält die Definition der Inhalte des "Laborbefundes" für das Österreichische Gesundheitswesen. Diese Spezifikation ist das Resultat einer Harmonisierungsarbeit mit dem Ziel medizinische Befunde, innerhalb der derzeit im Aufbau befindlichen österreichischen "Elektronischen Gesundheitsakte" (ELGA), als abgestimmte und einheitlich strukturierte Dokumente darzustellen. Das Dokument wurde von einer Arbeitsgruppe von Vertretern der Österreichischen Ärztekammer, von mehreren Krankenhausträgern und Spitälern, Universitäten und Fachgesellschaften, des österreichischen Normeninstitutes, von der Health Level 7 (HL7) Anwendergruppe Österreich, sowie Personen aus der Wirtschaft erstellt. Sowohl angestellte als auch niedergelassene Labormediziner waren massiv an der Erarbeitung beteiligt.
Die Abstimmung erfolgte gemeinsam mit anderen Arbeitsgruppen, die gleichzeitig an den Inhalten für den "Entlassungsbrief" und den "Befund bildgebende Diagnostik" arbeiten. Vor allem die Informationen über die betroffenen und handelnden Personen, Zeitangaben, Dokumentart und ähnliches im so genannten "Header" wurden eng abgestimmt und im Rahmen eines zentralen Dokumentes "Allgemeiner Implementierungsleitfaden für ELGA CDA Dokumente [OID Root 1.2.40.0.34.7.1]" [4] definiert.
Der Header enthält zum einen administrative Daten (allgemeine Angaben zum Dokument, Daten zum Patienten, usw.) und dient zum anderen zum Teil auch als Quelle für die Metadaten, die bei der Registrierung des Dokuments in ELGA verwendet werden. Der Header wurde über alle Anwendungsbereiche der ELGA einheitlich abgestimmt.
Die medizinisch relevanten Anteile sind im so genannten "Body" enthalten. Die vorliegende Spezifikation der laborspezifischen inkl. mikrobiologische Inhalte eines Labordokuments in ELGA wurde von der Expertengruppe beruhend auf einer Liste mit Vorgaben der österreichischen Gesellschaft für Labormedizin und klinische Chemie (ÖGLMKC) erstellt.
Als technische Basis dient das "Laboratory Technical Framework Volume 3 (LAB TF-3) Revision 3.0, 2011" ([3]) der "Integrating the Healthcare Enterprise" (IHE).
Das Verständnis eines "Laborbefundes" erstreckt sich in diesem Dokument über das gesamte Spektrum der laboranalytisch ermittelten Befunde. Die vorliegende Version definiert grundlegende Anforderungen für die Erstellung von Laborbefunden als CDA Dokumente. Insbesondere wurden Laborbefunde aus der Klinischen Chemie, Hämatologie, Immunchemie und Mikrobiologie/Bakteriologie in die Überlegungen mit einbezogen. Die gewählten Strukturen ermöglichen prinzipiell eine Übermittlung des gesamten Befundspektrums des Laborbereiches, jedoch sind die einzelnen Detailbereiche in folgenden Arbeiten detailliert zu analysieren, abzustimmen und für weitere Laborbefundarten zu definieren. Es existieren vielmehr auch dezidierte Bereiche - wie z.B. die Transfusionsmedizin – für die die Definitionen dieses Leitfadens aufgrund fehlender Strukturen und nicht definierter Codelisten nicht ausreichend sind. Dieser Leitfaden verwendet "Analysen" als Sammelbegriff für Laboruntersuchungen, Laborleistungen und Labormessgrößen.
3.3 Zielgruppe
Anwender dieses Dokuments sind Softwareentwickler und Berater, die allgemein mit Implementierungen und Integrationen im Umfeld der ELGA, insbesondere der ELGA-Gesundheitsdaten, betraut sind. Eine weitere Zielgruppe sind alle an der Erstellung von CDA-Dokumenten beteiligten Personen, einschließlich der Endbenutzer der medizinischen Softwaresysteme und der Angehörigen von Gesundheitsberufen.
4 Leitfadenerstellungs- und Harmonisierungsprozess
Für die Ausgestaltung der Inhalte von "CDA Implementierungsleitfäden" ist eine breite Beteiligung der Stakeholder wesentlich, um die praktische Nutzbarkeit und die Akzeptanz durch die ELGA-Benutzer sicherzustellen. Für diese interdisziplinären Expertengruppen stehen nicht die technischen, sondern vor allem medizinisch-inhaltliche Aspekte im Vordergrund. Die technischen Inhalte werden großteils von den Redaktionsteams beigetragen.
Ein wesentlicher Schritt auf dem Weg zur Interoperabilität der IT-Systeme im Gesundheitswesen ist die Einigung auf Vorgaben für einheitliche Dokumentation und Codierung der Information. Diese durch die Arbeitsgruppen erreichte "Harmonisierung" etabliert neue nationale Qualitätsstandards der medizinischen Dokumentation. Die Leitfäden werden über ein reguläres Standardisierungsverfahren ("Ballot") durch die HL7 Anwendergruppe Österreich (HL7 Austria) zu einem nationalen HL7 Standard.
Dieser Implementierungsleitfaden ist eine Weiterentwicklung des Laborbefunds 2.06.3 und entstand durch die Harmonisierungsarbeit der AG Labor- und Mikrobiologiebefund, die im Zeitraum von [TODO] Oktober 2020 bis November 2020 tagte. Die Teilnehmer der Arbeitsgruppe wurden durch ihre Organisation delegiert.
4.1 Autoren und Mitwirkende
Dieser Implementierungsleitfaden entstand durch die Harmonisierungsarbeit der "Arbeitsgruppe Labor- und Mikrobiologiebefund" bestehend aus nachfolgend genannten Personen:
4.1.1 Autoren
Das Redaktionsteam bestand aus folgenden Personen:
| Name | Organisation | Rolle |
|---|---|---|
| Mag. Dr. Stefan Sabutsch | ELGA GmbH, HL7 Austria | Autor, Herausgeber |
| DI Andrea Klostermann | ELGA GmbH | Autor |
| DI Nikola Tanjga | ELGA GmbH | Autor |
| DI Oliver Kuttin | ELGA GmbH | Autor |
Unter Mitwirkung von: Stephan Rainer-Sablatnig (ELGA GmbH), Nina Sjencic, B.A. (ELGA GmbH) TODO
4.1.2 Mitwirkende
Teilnehmer der Arbeitsgruppe Labor- und Mikrobiologiebefund 20201: TODO 1 Personen sind ohne Titel angegeben
4.1.3 Autoren und Mitwirkende vergangener Leitfadenversionen
Die erste Version dieses Implementierungsleitfadens (2.06) entstand durch die Harmonisierungsarbeit der "Arbeitsgruppe Laborbefund" im Zeitraum zwischen 2008 und 2012, bestehend aus den unten genannten Personen.
Herausgeber, Editor, CDA Koordinator Stefan Sabutsch (ELGA GmbH)
Autoren, Fachkoordinatoren und Moderatoren Stefan Sauermann (Fachhochschule Technikum Wien), Alexander Mense (Fachhochschule Technikum Wien, HL7 Austria), Stefan Sabutsch (ELGA GmbH, HL7 Austria), Matthias Frohner (Fachhochschule Technikum Wien)
AG Teilnehmer Georg Paucek (Medicon Medical Consulting), Franz Burghuber (Kurienversammlung der niedergelassenen Ärzte der OÖ Ärztekammer), Alexander Haushofer (Österreichische Ärztekammer, KH St. Pölten, Inst. für Laboratoriumsmedizin), Jörg Hofmann (Österreichische Ärztekammer, Wiener KAV, Sozialmedizinisches Zentrum Ost - Donauspital, Institut für Labormedizin), Gerhard Holler (Österreichische Ärztekammer, ON-K 238), Christof Jungbauer (Rotes Kreuz, Blutspendezentrale Wien), Thomas Leitha (Sozialmedizinisches Zentrum Ost), Walter Krugluger (Sozialmedizinisches Zentrum Ost), Helmut Mittermayer (Elisabethinen Linz), Susanna Michalek (Initiative-ELGA), Johann Perné (Medizinisches Labor Perné), Georg Mustafa (Österreichische Ärztekammer, Bundesfachgruppe Labor), Thomas Szekeres (Österreichische Ärztekammer), Bernhard Böhm (Vinzenz Gruppe Krankenhausbeteiligungs- und Management GmbH), Christian Cebulla (KAV Wien, Generaldirektion), Georg Endler (Wilhelminenspital der Stadt Wien, Zentrallabor, KAV Wien), Manuela Födinger (KFJ – Sozialmed. Zentrum Süd, Institut für Laboratoriumsdiagnostik), Andrea Griesmacher (Univ.Klin. Innsbruck, Zentralinst. Labordiagnostik), Walter-Michael Halbmayer (ÖQUASTA; KH Hietzing + NZ Rosenhügel, Institut f. Labordiagnostik, Susanne Hauptlorenz (LKH Vöcklabruck, Institut f. Med.Chem. Labordiagnostik u. Blutdepot), Konrad Hölzl (Wiener Krankenanstaltenverbund, KAV-IT), Wolfgang Hübl (KAV Wien,, Wilhelminenspital, Zentrallabor, ÖGLMKC), Christian Kampenhuber (GESPAG Gesundheitsinformatik-Bereichsleiter), Gerald Regenfelder (KABEG), Dietmar Reiter (Tilak, Informationstechnologie/IT-Abteilung), Harald Rubey (LK Weinviertel Mistelbach, Laborinstitut, NÖ LK-Holding), Dieter Schwartz (Med. Uni. Wien, Klinik f. Blutgruppenserologie u. Transfusionsmedizin), Beate Tiran (Kages Zentrallabor), Helmuth Gamper (Max management Consulting GmbH), Bernhard Göbl (act Management Consulting GmbH), Christian Kraml (Systema), Herbert Matzenberger (Systema), Michael Krausenbaum (vision4health Deutschland GmbH & Co. KG), Hans Richter (Labatech Handelsgesellschaft m.b.H.), Wolfgang Sischka (Assista Laborelectronics GmbH), Christoph Unfried (HCS, Health Communication Service), Ferenc Gerbovics (Fachhochschule Technikum Wien), Philipp Urbauer (Fachhochschule Technikum Wien), Harald Kessler (Medizinische Universität Graz, Institut für Hygiene, Mikrobiologie und Umweltmedizin)
Patronanz, Akkordierung, Ergänzungen, Zustimmung Clemens Auer (Bundesministerium für Gesundheit), Hubert Eisl (ELGA GmbH), Susanne Herbek (ELGA GmbH), Martin Hurch (ELGA GmbH), Oliver Kuttin (ELGA GmbH), Peter Fraunberger (Medizinisches Zentrallaboratorium GmbH), Josef Galler (Steiermärkische Krankenanstalten-ges.m.b.H.), Gerhard Gretzl (Solve Consulting), Ulrike Gruber-Mösenbacher (Landeskrankenhaus Feldkirch, Institut für Pathologie), Milo Halabi (Krankenhaus der Barmherzigen Schwestern Ried, Inst. f. Pathologie), Elisabeth Haschke-Becher (A.ö. Krankenhaus der Elisabethinen Linz, Institut für Medizinische und Chemische Labordiagnostik), Wolfgang Hiesl (Oö. Gesundheitsfonds / eHealth Management), Stylianos Kapiotis (Med. Uni. Wien, Klinisches Institut für Medizinische und Chemische Labordiagnostik), Peter Konrath (B&S Zentrallabor), Georg Lechleitner (Tilak, Abteilungsleiter Informationstechnologie/IT-Abteilung), Hubert Leitner (Steiermärkische Krankenanstalten-ges.m.b.H.), Helmut Lindorfer (Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH – AGES), Sabine Manhardt (Österreichische Ärztekammer, Sekretariat), Hans Georg Mustafa (Labor Dr. Hans Georg Mustafa, Fachgesellschaft Labormedizin), Achim Mühlberger (GRZ IT Center Linz GmbH), Michael Nebel (Gibodat EDV- und Organisationsberatungs GmbH), Susan Netzl (AUVA - Unfallkrankenhaus Meidling, Labor), Claudia Perndl (A.ö. Krankenhaus der Elisabethinen Linz, Institut für Medizinische und Chemische Labordiagnostik, EDV), Sven Plattner (BKH Hall in Tirol, EDV), Thomas Pöckl (NÖ Landeskliniken-Holding), Angelika Reiner-Concin (Sozialmedizinisches Zentrum Ost – Donauspital, Pathologisch-Bakteriologisches Institut), Alexander Schanner (NÖ Landesklinikenholding), Gerhard Schobesberger (Österreichische Ärztekammer, Labor Schobesberger), Christian Schweiger (Medizinische Universität Wien / AKH Wien, klinische Abteilung für Medizinisch-chemische Labordiagnostik), Peter Schöttel (Bartelt GmbH), Herbert Stekel (AKH Linz, Institut für Laboratoriumsmedizin), Romana Thiel (HCS, Health Communication Service), Michael Danninger (Labene), Peter Uher (Telekom Austria), Michael Weidenauer (Assista), Thomas Wrba (Medizinische Universität Wien) Andere ELGA Arbeitsgruppen: Entlassungsbrief Arzt und Pflege: Jürgen Brandstätter (CodeWerk Software Services and Development GmbH), Befundbericht Radiologie: Martin Weigl (AIMC), Andreas Lindner (Lindner TAC)
AG Laborbefund 2017 Die Änderungen für Version 2.06.2 wurde von der AG Laborbefund am 12.1.2017 abgenommen. Teilnehmer der AG Laborbefund waren: Maria Abzieher (Wiener Krankenanstaltenverbund) , Herbert Matzenberger (CompuGroup Medical CEE GmbH), Robert Alscher (Humanomed IT Solutions Gmbh), Daniel Außerdorfer (Univ.Klin. Innsbruck, Zentralinstitut für Medizinische und Chemische Labordiagnostik (ZIMCL)), René Berger (Synlab), Barbara Dall (CGM), Zeljko Drljaca (Institut für medizinische und chemische Labordiagnostik Gesellschaft m.b.H), Daniela Eisner (Salzburger Landeskliniken ) Christian Fersterer (Salzburger Landeskliniken), Matthias Frohner (FH Technikum Wien), Josef Galler (Steiermärkische Krankenanstalten-ges. m.b.H.), Andrea Griesmacher (Univ.Klin. Innsbruck, Zentralinstitut für Medizinische und Chemische Labordiagnostik (ZIMCL)), Gernot Gruber (Institut für medizinische und chemische Labordiagnostik Gesellschaft m.b.H), Sylvia Handler (biomed austria - Österreichischer Berufsverband der Biomedizinischen AnalytikerInnen), Susanne Hauptlorenz (Salzkammergut-Klinikum Vöcklabruck, Institut für Med.Chem. Labordiagnostik und Blutdepot), Alexander Haushofer (ÖGLMKC; Klinikum Wels-Grieskirchen), Wolfgang Hießl (Oö. Gesundheitsfonds / eHealth Management), Michael Hubmann (Med. Zentrallaboratorium GmbH), Günter Igler (Analyse BioLab; KH Elisabethinen Linz), Sonja Jansen-Skoupy (KAV Wien, SMZ Süd), Michael Krausenbaum (CGM LAB Deutschland GmbH), Herwig Loidl (Carecenter Software GmbH), Birgit Luxbacher (biomed austria - Österreichischer Berufsverband der Biomedizinischen AnalytikerInnen), Alexander Mense (Fachhochschule Technikum Wien, HL7 Austria), Hans Georg Mustafa (Labor Dr. Hans Georg Mustafa, BFG Med. u. Chem. Labordiagnostik, ÖGLMKC), Stefan Mustafa (Labor Doz. Mag. DDr. Stefan Mustafa), Michael Nöhammer (Ärztekammer Österreich), Thomas Pöckl (NÖ Landeskliniken-Holding) Elisabeth Presterl (Universitätsklinik für Krankenhaushygiene & Infektionskontrolle, Medizinische Universität Wien), Sebastian Reimer (BMGF), Harald Rubey (LK Weinviertel Mistelbach, Laborinstitut, NÖ LK-Holding), Stefan Sabutsch (ELGA GmbH, HL7 Austria), Ulrich Sagel (Universitätsklinik für Hygiene und Mikrobiologie), Karin Salzmann (Univ. Klinik für Innere Medizin Innsbruck), Clemens M. Sampl (BMGF), Stefan Sauermann (FH Technikum Wien, Interoperabilitätsforum Österreich), Peter Schöttel (Bartelt GmbH), Christian Schweiger (Medizinische Universität Wien / AKH Wien, klinische Abteilung für Medizinisch-chemische Labordiagnostik), Carina Seerainer (ELGA GmbH), Josef Seier (Klinikum Wels-Grieskirchen), Wolfgang Sischka (Assista Laborelectronics GmbH), Herbert Stekel (Kepler Universitätsklinikum GmbH), Michael Svizak (AUVA Hauptstelle - Ärztliche Direktion), Gerhard Weigl (Inst. f. Labormedizin – Otto-Wagner-Spital Wien)
1 Personen ohne Titel
5 Technischer Hintergrund
5.1 Grundlagen zu HL7 und CDA
5.2 Datentypen
Im Kapitel Datentypen im allgemeinen Leitfaden werden nur die Datentypen beschrieben, die in ELGA CDA-Dokumenten wie diesem zur Anwendung kommen. Für weiterführende Informationen wird auf den zugrundeliegenden Standard Health Level Seven Version 3 (V3), Normative Edition verwiesen.
5.3 Allgemeine Richtlinien für ELGA CDA-Implementierungsleitfäden
Die allgemeinen Richtlinien für ELGA CDA-Implementierungsleitfäden sollen beachtet werden.
6 Vorgaben zum medizinischen Inhalt
6.1 Allgemeiner Laborbefund
Die inhaltlichen Definitionen beruhen auf den Mindestvorgaben der österreichischen Gesellschaft für Labormedizin und klinischen Chemie (ÖGLMKC) und wurden weiter verfeinert. Tabelle 1 zeigt einen Überblick über die inhaltlich abzubildenden medizinisch relevanten Daten.
| Feld | Beschreibung | Bereich |
|---|---|---|
| Allgemeine Befundinformationen | ||
| Zeitpunkt der Auftragserfassung | Datum und Zeitpunkt, an dem das analysierende Labor die Anforderung vom Zuweiser in der Labor EDV erfasst hat | Header |
| Auftragsdiagnose (Zuweiserdiagnose) | Vom Auftraggeber bestimmte und dem Labor übermittelte Verdachtsdiagnose | Body |
| Überweisungsgrund | Vom Auftraggeber übermittelter Überweisungsgrund/Fragestellung | Body |
| Befundtext | Kommentar zum gesamten Befund | Body |
| Spezimeninformation | ||
| Zeitpunkt der Spezimengewinnung | Damit ist jenes Datum und Zeitpunkt gemeint, an dem das Spezimen zur Analyse gewonnen wurde. Die Dokumentation des Zeitpunkts der Spezimengewinnung ist in der Verantwortung der entnehmenden Person, die in vielen Fällen mit dem Befundersteller nicht identisch ist, da meist Spezimen zur Analyse an Labors versendet werden. Daher ist der Zeitpunkt vielfach im Labor nicht feststellbar. | Body |
| Zeitpunkt des Einlangens des Spezimen | Datum und Zeit der Probenannahme im Labor | Body |
| Art des Spezimens (Specimen Type) | Art der Probe (=Materialart) | Body |
| Entnahmeort | Angabe der Körperstelle, von der das Spezimen stammt | Body |
| Entnahmeart (SpecimenCollectionProcedure) | Art der Gewinnung | Body |
| Specimen ID | Eindeutige Nummer des Spezimen | Body |
| Entnehmende Person (Performer) | Person, welche die Entnahme der Probe durchgeführt hat | Body |
| Kommentar zum Spezimen | Präanalytik pro Spezimen zur Spezimenqualität | Body |
| Allgemeine Anmerkungen des Labors zur Spezimenqualität | Textinformationen zur Spezimenqualität | Body |
| Allgemeine Laborergebnisse | ||
| Gruppierung / Befundgruppen (Organizer) | Analysengruppierung | Body |
| ID des Tests | Eindeutige Codierung des Tests | Body |
| Analysenbezeichnung | Bezeichnung der Analyse (aus dem Value Set ELGA_Laborparameter) |
Body |
| Ergebnis | Body | |
| Einheit | Body | |
| Referenzbereiche | Für die Beurteilung relevante Referenzwerte. Die Angabe mehrerer Referenzbereiche zu einem Test ist möglich. | Body |
| Befundinterpretation | Codierte Bewertung des Ergebnisses | Body |
| Deltacheck | Tendenzielle Veränderung zu Vorwerten | Body |
| Ergebniskommentar | Kommentar des Labors zu einem einzelnen Testergebnis | Body |
| Externes Labor | Kennzeichen ob ein Ergebnis extern ermittelt wurde | Body |
Tabelle 1: Im Laborbefund abzubildende medizinische Daten
6.1.1 Bereiche (Specialities)
Jeder CDA–Laborbefund ist laut vorliegender Headerdefinition als "Multidisciplinary Report" ausgewiesen (vgl. Kapitel 5.1.2), kann jedoch mehrere unterschiedliche Teilbefunde aus verschiedenen Bereichen im Body des Dokumentes beinhalten (z.B. Hämatologie oder Bakteriologie oder beide Arten gemeinsam). D.h. diese Teilbefunde bilden die erste Gliederungsebene des Bodys - die "Bereiche" oder - in Anlehnung an die Definitionen der "IHE" – "Specialities" (vgl. [3]). zeigt die mögliche Gliederung auf der ersten Ebene innerhalb des Bodys.
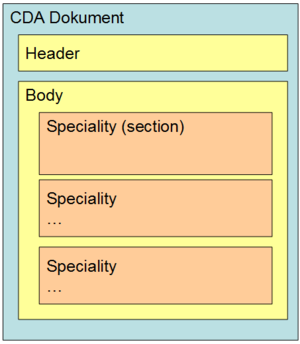
Abbildung 1: Gliederung nach Bereiche /Specialities
Die derzeit für den österreichischen Laborbefund definierten Specialities werden im Rahmen des hierarchisch organisierten Value Sets "ELGA_Laborstruktur" definiert, wobei für Bereiche nur Einträge der Ebene 0 und 1 verwendet werden dürfen. gibt einen auszugsweisen Überblick über die derzeit festgelegten Specialities. Die Anwendung der Bereiche ist optional. Es können auch alle Untersuchungen in einer Section unter dem Bereich "Allgemeiner Laborbefund" zusammengefasst werden. Bei Verwendung der Bereiche ist die Reihenfolge gem. Value Set verpflichtend einzuhalten.
Für EIS "Enhanced" ist die Codierung der Bereiche (als unterschiedliche section-Elemente) zwingend vorgeschrieben.
| Code | Bereich (Speciality) |
|---|---|
| 100 | Blutgruppenserologie |
| 200 | Blutgasanalytik |
| 300 | Hämatologie |
| 400 | Gerinnung/Hämostaseologie |
| … | … |
Tabelle 2: Liste der Bereiche, auszugsweise gem. ELGA Value Set "ELGA_Laborstruktur", die sich auch in ELGA_Laborparameter widerspiegelt.
6.1.2 Gruppen (Befundgruppen)
Innerhalb dieser Bereiche erfolgt in der Regel eine Strukturierung und Gliederung der Ergebnisse zur besseren Lesbarkeit und Auffindbarkeit in "Befundgruppen". Das ELGA Value Set "ELGA_Laborstruktur" definiert zulässige Befundgruppen. Es besteht jedoch auch die Möglichkeit Ergebnisse ohne Befundgruppenstrukturierung zu übermitteln. zeigt die möglichen Gliederungsarten.
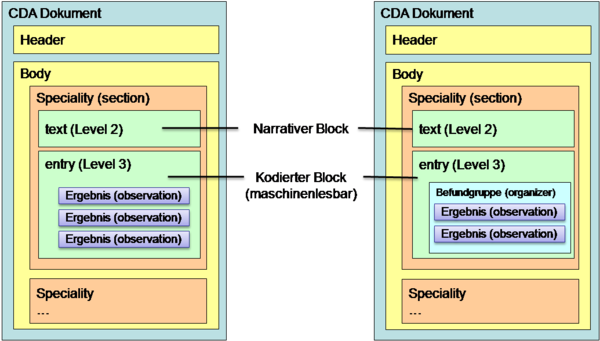
Abbildung 2: Strukturierungsmöglichkeiten Body
und zeigen Ausschnitte aus Beispielen zu Laborbefunden mit Befundgruppen und den entsprechenden medizinischen Inhalten. Der "Allgemeine Laborbefund" enthält die Bereiche "Hämatologie" und "Hämostaseologie" mit darunter liegenden Befundgruppen; der "Bakteriologische Befund" enthält ein Bespiel für die Darstellung eines Antibiogrammes.
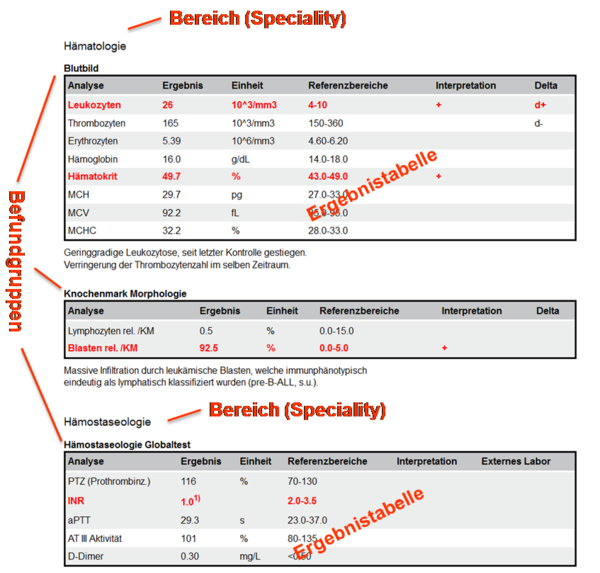
Abbildung 3: Ausschnitt Beispielbefund
Bereiche (Specialities) und Gruppen werden in CDA Level 3 in entsprechende Klassen umgesetzt und gemäß des hierarchischen Value Sets "ELGA_Laborstruktur" codiert. Die Codierung der Bereiche erfolgt durch Elemente der ersten und zweiten Ebene (0 bzw. 1) und die der Befundgruppen durch Elemente der drittenValue Set Ebene (2). Die Reihenfolge der Bereiche bzw. Gruppen gem. Value Set ist verpflichtend einzuhalten.
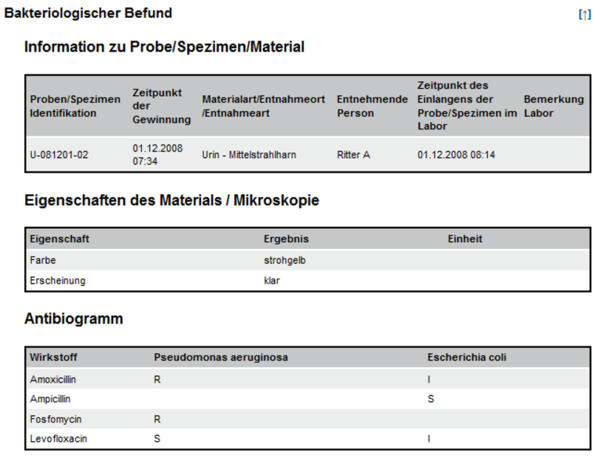
Abbildung 4: Ausschnitt Bakteriologie Beispielbefund
6.2 Mikrobiologische Befunde
Unter den Analysen eines Laborbefunds finden sich viele aus dem Bereich der Mikrobiologie. Dieser Teil des Leitfadens beschäftigt sich mit den mikrobiologischen Methoden und Analysen im Labor, die sich nicht über die "klassische" Struktur eines Laborbefundes darstellen lassen. Dies betrifft hauptsächlich die Bakteriologie zum Nachweis von Bakterien, z.B. mit der Darstellung von Keimwachstum, Koloniebeschreibung und Antibiogrammen. Die Strukturierung des mikrobiologischen Befundes folgt einem bestimmten Muster, das den Untersuchungsverlauf widerspiegelt: Beschreibung des entnommenen Materials (z.B. Mittelstrahlharn), die direkt untersuchten Eigenschaften des Materials (z.B. Farbe), mikroskopische Untersuchung des Materials (z.B. Erythrozyten, Leukozyten, grampositive Bakterien). Falls Bakterienwachstum festgestellt wird, folgt eine Beschreibung der Kulturen, eine Benennung der Reinkulturen (Isolate) mit Nennung der taxonomischen Bestimmung der Mikroorganismen (z.B. Streptococcus pyogenes) ggf. mit Angabe des Serovars/Pathovars. Meist wird ein Antibiogramm angefügt. Es kann auch eine minimale Hemmkonzentration (MHK) enthalten sein.
Dementsprechend ist folgende hierarchische Struktur abzubilden:

Tabelle 3 zeigt einen Überblick über die inhaltlich abzubildenden medizinisch relevanten Daten für den mikrobiologischen Befund.
| Feld | Beschreibung | Bereich |
|---|---|---|
| Allgemeine Befundinformationen | ||
| Zeitpunkt der Auftrags-erfassung | Datum und Zeitpunkt, an dem das analysierende Labor die Anforderung vom Zuweiser in der Labor EDV erfasst hat | Header |
| Auftragsdiagnose (Zuweiserdiagnose) | Vom Auftraggeber bestimmte und dem Labor übermittelte Verdachtsdiagnose | Body |
| Überweisungsgrund | Vom Auftraggeber übermittelter Überweisungsgrund/Fragestellung | Body |
| Angeforderte Untersuchungen | Vom Auftraggeber angeforderte Untersuchungen bzw. das angeforderte Analysespektrum | Body |
| Befundtext | Kommentar zum gesamten Befund | Body |
| Spezimeninformation | ||
| Zeitpunkt der Spezimengewinnung | Damit ist jenes Datum und Zeitpunkt gemeint, an dem das Spezimen zur Analyse gewonnen wurde. Die Dokumentation des Zeitpunkts der Spezimengewinnung ist in der Verantwortung der entnehmenden Person, die in vielen Fällen mit dem Befundersteller nicht identisch ist, da meist Spezimen zur Analyse an Labors versendet werden. Daher ist der Zeitpunkt vielfach im Labor nicht feststellbar. | Body |
| Zeitpunkt des Einlangens des Spezimen | Datum und Zeit der Probenannahme im Labor | Body |
| Art des Spezimens (Specimen Type) | Art der Probe (=Materialart) | Body |
| Entnahmeort | Angabe der Körperstelle, von der das Spezimen stammt | Body |
| Entnahmeart (SpecimenCollectionProcedure) | Art der Gewinnung | Body |
| Specimen ID | Eindeutige Nummer des Spezimen | Body |
| Entnehmende Person (Performer) | Person, welche die Entnahme der Probe durchgeführt hat | Body |
| Kommentar zum Spezimen | Präanalytik pro Spezimen zur Spezimenqualität | Body |
| Allgemeine Anmerkungen des Labors zur Spezimenqualität | Textinformationen zur Spezimenqualität | Body |
| Mikrobiologische Laborergebnisse | ||
| Makroskopie | Allgemeine Information über die Materialbeschaffenheit | Body |
| Mikroskopie | Mikroskopiesche Beobachtungen betreffend des Materials/Spezimen | Body |
| Kultureller Erregernachweis | Angabe von Ergebnissen, welche mit Hilfe von Kulturen erlangt werden | Body |
| Antibiogramm | Angaben zur Empfindlichkeit bzw. Resistenz von mikrobiellen Krankheitserregern gegenüber Antibiotika | Body |
| Minimale Hemmkonzentration | Angaben zur minimalen Hemmkonzentration bezüglich der Empfindlichkeit bzw. Resistenz von mikrobiellen Krankheitserregern gegenüber Antibiotika | Body |
| Molekularer Erregernachweis | Ergebnisse von molekularen Erregernachweisen | Body |
| Infektionsserologie | Ergebnisse von infektionsserologisch relevanten Analysen | Body |
Tabelle 3: Im mikrobiologischen Befund abzubildende medizinische Daten
7 Funktionale Anforderungen
7.1 Voraussetzungen für den Zugriff auf e-Befunde in ELGA
Der ELGA GDA ist in ELGA angemeldet, berechtigt und besitzt eine gültige Kontaktbestätigung für den Patienten. Der Patient ist ELGA-Teilnehmer und hat keinen generellen, partiellen oder situativen Widerspruch hinsichtlich ELGA eingelegt.
7.2 Anwendungsfälle des Dokumentenmanagements
Die folgenden Kapiteln aus dem allgemeinen Leitfaden stellen eine Zusammenfassung der Inhalte der ELGA-Gesamtarchitektur, des Leitfadens XDS Metadaten und Usability Styleguides zum Thema e-Befunde dar. Detailinformationen sind in den entsprechenden Dokumenten nachzulesen (verfügbar auf der Homepage der ELGA GmbH). Die wesentlichen Anwendungsfälle sind
- Schreiben und Einbringen von Dokumenten
- Versionierung von Dokumenten
- Stornierung von Dokumenten
- Filtern und Suchen von Dokumenten
- Lesen von Dokumenten
7.2.1 Dokument-Metadaten (XDS-Metadaten) Einschränkung
TODO: Anpassen, derzeit TME!
| XDS-Mapping | Optio-
nalität |
CDA-Element
clinicalDocument. |
Beispiel | Erklärung |
|---|---|---|---|---|
| formatCode | R | .templateId/@extension |
|
Version des Implementierungsleitfaden Telemonitoring Episodenbericht mit XDSdocumentEntry.formatCode als Extension.
Das templateId-Element mit einer Extension beginnend mit "XDSdocumentEntry.formatCode^" wird ins XDS-Attribut formatCode gemappt (ohne Präfix XDSdocumentEntry.formatCode^). |
| typeCode | R | .code |
|
Zur Unterscheidung des Dokumenttyps erhält das Element clinicalDocument.code des "Telemonitoring Zwischen-Episodenbericht" ein vorgegebenes "code"-Element. |
|
Zur Unterscheidung des Dokumenttyps erhält das Element clinicalDocument.code des "Telemonitoring Entlassungs-Episodenbericht" ein vorgegebenes "code"-Element. | |||
| classCode | R | .code.translation |
|
Bezeichnet die "Dokumentklasse" in dem untergeordneten "translation"-Element. Einzig zulässige Wert für den telemonitoring Episodenbericht ist Telehealth note (75496-0). |
| title | R | .title | Bsp.: "Zwischenbericht Herz-Mobil Steiermark (23.3.2020-30.4.2020)" | Für den Telemonitoring Episodenbericht mit dem LOINC Code 75497-8 (Telehealth Progress note) muss der Titel mit "Zwischenbericht" beginnen. Danach soll das Telegesundheitsdienste-System angegeben werden und mit dem Zeitraum der in dem Dokument vorhandenen Daten enden. |
| Bsp.: "Entlassungsbericht Herz-Mobil Tirol (5.2020)" | Für den Telemonitoring Episodenbericht mit dem LOINC Code 75498-6 (Telehealth Summary note) muss der Titel mit "Entlassungsbericht" beginnen. Danach soll das Telegesundheitsdienste-System angegeben werden und mit dem Zeitraum der in dem Dokument vorhandenen Daten enden. | |||
| eventCodeList | R | .documentationOf
.serviceEvent.code |
|
Code der Gesundheitsdienstleistung. |
| serviceStartTime | R | .documentationOf.serviceEvent
.effectiveTime.low |
Zeitpunkt des Behandlungsbeginns (erster medizinisch relevanter Behandlungstag dieser dokumentierter Gesundheitsdienstleistung) | Beginn der Gesundheitsdienstleistung. |
| serviceStopTime | R | .documentationOf.serviceEvent
.effectiveTime.high |
Zeitpunkt des Behandlungsendes (letzter medizinisch relevanter Behandlungstag dieser dokumentierter Gesundheitsdienstleistung, muss sich von Behandlungsbeginn unterscheiden) | Ende der Gesundheitsdienstleistung. |
8 Konformitätsprüfung
Ein zu diesem Implementierungsleitfaden konformes CDA-Dokument ist zunächst ein valides CDA Release 2.0 XML-Dokument mit Header und Body. Darüber hinaus erfüllt es alle in diesem Leitfaden festgelegten "Geschäftsregeln".
Dies spiegelt ein generelles Konzept im Umgang mit Dokumenten wieder: die Validierung in zwei Schritten. Im ersten Schritt stellt dies die Validierung gegen zugehörige W3C Schemas dar. Das verwendete Schema ist das geringfügig erweiterte offizielle CDA Release 2.0 Schema (siehe Schema-Prüfung). Darüber hinaus existieren eine Reihe von Schematron Regeln, die für einen zweiten Validierungsschritt genutzt werden und letztlich die Detailregelungen in diesem Leitfaden wiedergeben, sowie die Einhaltung der Geschäftsregeln (Optionalität, Kardinalität/Multiplizität, Datentypen, Wertebereiche, Abhängigkeiten) sicherstellen (siehe Schematron-Prüfung). Geschäftsregeln für Abschnitte oder Elemente werden auch technisch zu "Templates" zusammengefasst. Eine XML-Instanz, die kein valides CDA-Dokument ist oder sich nicht gegen das XSD-Schema validieren lässt oder im Widerspruch zu den angegebenen Geschäftsregeln steht, ist kein gültiges CDA-Dokument im Sinne dieses Implementierungsleitfadens.
Hinweis: Nicht alle Geschäftsregeln können mit Schema oder Schematron geprüft werden (etwa Inhalte von Multimedia-Attachments, Dokumentengröße). Zusätzliche Validierungsschritte sind gegebenenfalls notwendig, um alle Regeln zu überprüfen zu können.
Die Kapitel zu den technischen Konformitätsprüfungen von CDA-Dokumenten, gemäß diesem Dokumentleitfadens mittels Schema und Schematron, sind im allgemeinen Leitfaden unter den folgenden Links zu finden:
9 Anwendungsfälle
Die Einsatzszenarien für dieses Datenaustauschformat werden in Form von Anwendungsfälle beschrieben, um dem Leser den Hintergrund zu vermitteln. Diese Beschreibung der Anwendungsfälle ist nicht normativ und keine Vorentscheidung für die tatsächliche Umsetzung.
TODO: Die Definition in passendes Kapitel verschieben.
Definition: Der Laborbefund wurde für die Arbeit an diesem Leitfaden wie folgt definiert:
Ein Laborbefund (aus dem Bereich der med. u. chem. Labordiagnostik) ist der fachärztlich vidierte, kommentierte/interpretierte Befund morphologischer, biologischer, chemischer, molekularer, physikalischer und spezieller immunologischer Untersuchungsverfahren aus Körpersäften, der Beurteilung ihrer morphologischen Bestandteile sowie von ab- und ausgeschiedenem Untersuchungsmaterial zur Erkennung physiologischer Eigenschaften, krankhafter Zustände, zu Verlaufskontrollen und zur Gesundheitsvorsorge/Prophylaxe.
ELGA Laborbefunde umfassen u. a. klinische Chemie und Immunchemie, Hämatologie (Erkrankungen des Blutes) und Hämostaseologie (Störungen der Blutgerinnung), Proteinchemie, Serologie, molekulare Diagnostik, Toxikologie, Drugmonitoring, Mikrobiologie, Infektionsserologie, Zytologie, Untersuchungen und die Hilfestellung für andere Fächer im Rahmen von Therapievorschlägen bei Gerinnungsstörungen, Antikoagulanzientherapien, der Impfkontrolle, Vorsorgediagnostik und Risikostratifizierung.
Untersuchungen des Sonderfaches "Blutgruppenserologie und Transfusionsmedizin" werden in einer gesonderten ELGA Dokumentenklasse (geplant) abgehandelt.
Sofern keine andere Regelung zutrifft, obliegt die Entscheidung ob ein Befund in ELGA gestellt wird dem Befundersteller.
Im ELGA Laborbefund dürfen nur dann Ergebnisse aus genetischen Analysen enthalten sein, wenn ihre Dokumentation in Übereinstimmung mit dem Gentechnikgesetz (GTG § 71a, BGBl. I Nr. 127/2005) erfolgt.
Der in diesem Leitfaden beschriebene Laborbefund dient also zum Austausch von fertiggestellten, und fachärztlich vidierten Befunden innerhalb und zwischen Einrichtungen des Gesundheitswesens. Ein wesentlicher Nutzer der Befunde ist auch der Patient selbst, der die Befunde über das ELGA Bürgerportal einsehen wird.
Der in diesem Leitfaden beschriebene Laborbefund ist zur Dokumentation und Kommunikation (vollständig) fertiggestellter Laborbefunde gedacht.
Der hier beschriebene Laborbefund ist nicht vorgesehen um Zwischenergebnisse und Nachrichten über einzelne Prozessschritte zu kommunizieren, wie etwa
- die Anforderung von Laboruntersuchungen
- das Einlangen einer Probe im Labor
- den Beginn, Stornierung oder die Fertigstellung einzelner Untersuchungen
Ergänzungen und Korrekturen von Laborbefunden werden unterstützt
9.1 Anwendungsfall LAB01: "Laboruntersuchung eines niedergelassenen Labors"
Typischerweise entstehen Laborbefunde in medizinischen Labors. Einerseits sind das niedergelassene Labors, die als selbständige Unternehmen Laboruntersuchungen anbieten. Diese werden vielfach auf Zuweisung von Patienten durch praktische Ärzte im niedergelassenen Bereich tätig. Die Entstehung eines Laborbefundes beginnt mit einer Überweisung durch einen niedergelassenen Arzt, oder mit einer Anforderung innerhalb eines Spitals. Entweder wird das Spezimen am Patienten gleichzeitig entnommen, und dann ins Labor geschickt oder der Patient muss das Labor aufsuchen, und das Spezimen wird dann erst dort entnommen. Nach Abschluss der Untersuchung wird der Befund dem zuweisenden Arzt und/oder dem Patienten in Papierform übermittelt.
Laboruntersuchungen im Rahmen ambulanter Aufenthalte in einem Spital fallen ebenso unter diesen Anwendungsfall.
9.2 Anwendungsfall LAB02: "Laboruntersuchung im Rahmen eines stationären Aufenthalts in einem Spital"
Im Rahmen von stationären Aufenthalten von Patienten in Spitälern kommt es in der Regel zu einer Reihe von Laboruntersuchungen, die in der internen Krankengeschichte (meistens auch elektronisch) abgelegt werden. Relevante Befunde werden dem einweisenden Arzt bzw. dem Patienten im Zuge der Entlassungsdokumentation mit übermittelt. Dieses passiert oftmals als Teil des Entlassungsbriefes. Welche Werte und welche Befunde entsprechende Relevanz haben um weitergeleitet zu werden, entscheidet das jeweilige ärztliche Fachpersonal in der Klinik.
9.3 Anwendungsfall LAB03: "Teilweise externe Vergabe von Laboruntersuchungen"
In vielen Fällen kommt es zu Kooperationen zwischen Laborbefund erstellenden Organisationen. Folgende Fälle seien angeführt:
- Spitäler kooperieren mit niedergelassenen Labors. Zum Teil verfügen nicht alle Spitäler über eigene Labors, andererseits werden auch Spezialuntersuchungen, die das Spitalslabor nicht durchführt, an niedergelassene Labors vergeben.
- Niedergelassene Labors verfügen nicht über das volle Leistungsspektrum und senden Laboruntersuchungen an Spitallabors, welche spezielle Parameter messen können.
- Es bestehen Kooperationen zwischen mehreren Spitälern. Einerseits sind das oft Spitäler, die dem gleichen Spitalsträger angehören. Teilweise bestehen auch Kooperationen zwischen Spitälern unterschiedlicher Träger, die durch die örtliche Nähe leicht Proben austauschen können.
In allen Fällen werden einzelne Labortests nicht selbst durchgeführt sondern diese Tests an ein externes kooperierendes Labor vergeben. Das externe Labor führt dann den Test durch, und übermittelt die Ergebnisse an das ursprünglich für die Untersuchungen zuständige Labor. Dort werden dann die vom externen Labor ermittelten Testergebnisse in den eigenen Laborbefund eingefügt. Das ursprünglich zuständige Labor, das den Befund erstellt, muss in diesem Fall die extern erbrachten Testergebnisse als solche erkennbar kennzeichnen.
9.4 Anwendungsfall LAB04: "Update von Laborbefunden"
Ein fertiggestellter Laborbefund wird korrigiert oder ergänzt, um
- die Inhalte des Befundes zu korrigieren (etwa das Ergebnis einer Analyse),
- einzelne (fehlerhafte) Analysen nachträglich aus dem Befund zu stornieren oder
- fehlende Analysen zu ergänzen (etwa besonders lang dauernde Analysen).
Änderungen sollen im Text für den Leser klar kenntlich gemacht werden (eine codierte Angabe kann im narrativen Text mit Revisionsmarken erfolgen).
Eine Korrekturversion MUSS in ELGA immer alle zum Befund gehörigen Analysen enthalten, da die Vorversion als veraltet (deprecated) gekennzeichnet wird. Stornierte Analysen sind explizit mit dem entsprechenden StatusCode zu kennzeichnen.
Für den Leser/Empfänger gilt: Eine neue Version ersetzt die alte Version des Befundes, alle Analysen sollen beim Import ersetzt bzw. überschrieben werden. Sollte eine Analyse in der neuen Version fehlen, soll diese als "storniert" interpretiert werden.
10 Dataset des Labor- und Mikrobiologiebefunds
Das Dataset (auch "Datenarten" oder "Konzepte") listet alle mit der Arbeitsgruppe abgestimmten Inhalte des Leitfadens auf. Es enthält Beschreibungen der Elemente mit Synonymen.
Dataset-Elemente können auf das CDA Datenmodell gemappt werden. In den Metadaten eines Templates sind alle assoziierten Konzepte auf einen Blick ersichtlich. Im Template-Body wird das assoziierte Konzept beim entsprechenden Datenelement angezeigt.
Die Live-Version des Datasets in Art-Decor kann unter folgendem Link betrachtet werden.
11 Technische Spezifikation
Die Struktur des CDA Austauschformats ist in den nachfolgenden Kapiteln im Detail beschrieben.
Der Header entspricht mit Ausnahme der erwähnten Abweichungen den bisherigen ELGA CDA-Leitfäden ("Allgemeiner Leitfaden"). Der Body enthält die tatsächlichen (medizinischen) Inhalte des Dokuments. Dieses Dokument existiert ausschließlich in einer voll strukturierten Form, eine Unterscheidung der Interoperabilitätsstufen ist daher nicht notwendig.
11.1 Übersichtstabelle der CDA Strukturen des Headers
Dieses Kapitel gibt einen Überblick über die Elemente des CDA Headers und den Vorgaben bezüglich Kardinalität und Konformität.
Der aktuelle Leitfaden ist für den ELGA Kontext entwickelt worden, kann jedoch auch für andere Zwecke, welche als eHealth zusammengefasst werden, verwendet werden.
| Element | Kard/Konf ELGA | Kard/Konf eHealth | Bedeutung / Link zum Kapitel |
|---|---|---|---|
| realmCode | 1..1 M | 1..1 M | Hoheitsbereich des Dokuments |
| typeId | 1..1 M | 1..1 M | Kennzeichnung CDA R2 |
| templateId | 3..* M | 3..* M | Kennzeichnung von Strukturvorschriften |
| id | 1..1 M | 1..1 M | Dokumenten-Id |
| code
translation |
1..1 M
1..1 M |
1..1 M
0..* R |
Klassifikation des Dokuments (fein und grob) |
| title | 1..1 M | 1..1 M | Titel des Dokuments |
| sdtc:statusCode | 0..1 C | 0..1 O | Status des Dokuments |
| hl7at:terminologyDate | 1..1 M | 0..1 O | Terminologie-Datum des Dokuments |
| hl7at:formatCode | 1..1 M | 0..1 O | FormatCode des Dokuments |
| hl7at:practiceSettingCode | 1..1 M | 0..1 O | Fachliche Zuordnung des Dokuments |
| effectiveTime | 1..1 M | 1..1 M | Erstellungsdatum des Dokuments (medizinisch relevantes Datum) |
| confidentialityCode | 1..1 M | 1..1 M | Vertraulichkeitscode |
| languageCode | 1..1 M | 1..1 M | Sprachcode des Dokuments |
| setId
versionNumber |
1..1 M
1..1 M |
1..1 M
1..1 M |
Versionierung des Dokuments |
| recordTarget | 1..1 M | 0..1 C | Patient |
| recordTarget de-identified | 0..0 NP | 0..1 C | Anonymer oder pseudonymisierter Patient |
| author | 1..* M | 1..* M | Verfasser des Dokuments |
| dataEnterer | 0..1 O | 0..1 O | Personen der Dateneingabe |
| informant | 0..* O | 0..* O | Informant |
| custodian | 1..1 M | 1..1 M | Verwahrer des Dokuments |
| informationRecipient | 0..* O | 0..* O | Beabsichtigte Empfänger des Dokuments |
| legalAuthenticator | 0..* C | 0..* C | Rechtlicher Unterzeichner, wird im speziellen Leitfaden definiert. |
| authenticator | 0..* O | 0..* O | Weitere Unterzeichner |
| participant | 0..* O | 0..* O | Weitere Beteiligte (nähere Unterscheidung im entsprechenden Leitfaden) |
| inFulfillmentOf | 0..* O | 0..* O | Zuweisung und Ordermanagement |
| documentationOf
serviceEvent |
0..* O
1..1 M |
0..* O
1..1 M |
Gesundheitsdienstleistungen |
| relatedDocument | 0..1 O | 0..1 O | Bezug zu vorgehenden Dokumenten |
| authorization | 0..0 NP | 0..* O | Einverständniserklärung |
| componentOf
encompassingEncounter |
0..1 O
1..1 M |
0..1 O
1..1 M |
Patientenkontakt (Aufenthalt) |
11.2 Übersichtstabelle der Header-Elemente für dokumenten-relevante Zeitpunkte/Zeitspannen
Dieses Kapitel gibt einen Überblick über die Elemente des CDA Headers mit Zeitangaben und ihre Zusammenhänge.
Der aktuelle Leitfaden ist für den ELGA Kontext entwickelt worden, kann jedoch auch für andere Zwecke, welche als eHealth zusammengefasst werden, verwendet werden.
| Element | Kard/Konf
ELGA |
Kard/Konf
eHealth |
Bedeutung | Link zum Kapitel |
|---|---|---|---|---|
| hl7at:terminologyDate | 1..1 M | 0..1 O | Das Datum, an dem die lokal zur Implementierung verwendeten Value Sets mit dem österreichischen Terminologieserver abgeglichen wurden, wird hier angegeben. | Terminologie-Datum des Dokuments |
| effectiveTime | 1..1 M | 1..1 M | Das letzte medizinisch relevante Datum, an welchem das Dokument medizinische Inhalte hinzugefügt worden sind. Kann im speziellen Leitfaden anders definiert werden. | Erstellungsdatum des Dokuments |
| recordTarget
birthTime |
1..1 M
1..1 R |
0..1 C
1..1 R |
Der Geburtstag des Patienten. | Patient |
| recordTarget
deceasedTime |
1..1 M
0..1 O |
0..1 C
1..1 R |
Das Sterbedatum des Patienten. | Patient |
| author
time |
1..* M
0..1 R |
1..* M
0..1 R |
Das jeweilige Datum, an welche der jeweilige Autor neue medizinische Informationen hinzugefügt hat. | Verfasser des Dokuments |
| dataEnterer
time |
0..1 O
0..1 R |
0..1 O
0..1 R |
Das Datum, an welchem eine Schreibkraft die Informationen aus einem Medium in das CDA Dokument überträgt, ohne weitere fachliche Informationen hinzuzufügen. | Personen der Dateneingabe |
| legalAuthenticator
time |
0..* C
1..1 R |
0..* C
1..1 R |
Die Zeitpunkte, an welchem das Dokument von den einzelnen berechtigten Personen vidiert wurde. Diese Personen sind die Hauptunterzeichner. Ist im jeweiligen speziellen Implementierungsleitfaden genauer vorgeschrieben. Dieser Zeitpunkt, wenn vorhanden, sollte nach author.time und dataenterer.time liegen. | Rechtlicher Unterzeichner |
| authenticator
time |
0..* O
1..1 R |
0..* O
1..1 R |
Die Zeitpunkte, an welchem das Dokument von den einzelnen berechtigten Personen vidiert wurde. Diese Personen sind die weiteren Unterzeichner. | Weitere Unterzeichner |
| Notfallkontakt / Auskunftsberechtigte Person
participant [templateId[@root='1.2.40.0.34.6.0.11.1.27']] time |
0..* O
0..1 O |
0..* O
0..1 O |
Zeitraum, in dem der angegebene Kontakt den Notfall-Kontakt darstellt.
Wird nur angegeben, wenn der Kontakt bereits absehbar nur in einem eingeschränkten Zeitraum zur Verfügung steht. |
Weitere Beteiligte |
| Versicherter/Versicherungparticipant
participant [templateId[@root='1.2.40.0.34.6.0.11.1.26']] time |
0..* O
0..1 O |
0..* O
0..1 O |
Gültigkeitszeitraum der Versicherungspolizze. | Weitere Beteiligte |
| documentationOf serviceEvent |
0..* O 1..1 M |
0..* O 1..1 M |
Zeitraum der durchgeführten Gesundheitsdienstleistung. Ist im jeweiligen speziellen Implementierungsleitfaden genauer vorgeschrieben. | Gesundheitsdienstleistungen |
| componentOf encompassingEncounter |
0..1 O 1..1 M |
0..1 O 1..1 M |
Zeitraum des Patientenkontakts. | Patientenkontakt (Aufenthalt) |
11.3 Übersichtstabelle der CDA Strukturen des Bodys
Dieses Kapitel gibt einen Überblick über die Elemente des CDA Bodys und den Vorgaben bezüglich Kardinalität und Konformität.
| Element | Kard/Konf | Bedeutung / Link zum Kapitel |
|---|---|---|
| Brieftext | 0..1 O | Brieftext, welches auch das Logo beinhaltet |
| Behandlungsgrund | 1..1 M | Behandlungsgrund |
| Zusammenfassung der Behandlung | 0..1 O | Zusammenfassung der Behandlung |
| Auszüge aus erhobene Daten | 0..1 O | Auszüge aus erhobene Daten |
| Erhobene Daten | 0..1 O | Erhobene Daten |
| Verwendete Geräte | 0..1 O | Verwendete Geräte |
| Beilagen | 0..1 O | Beilagen |
11.4 CDA Templates
11.4.1 Document Level Templates
11.4.1.1 Labor- und Mikrobiologiebefund
11.4.2 Header Level Templates
Wichtiger Hinweis: Header-Element welche spezifisch für den Labor- und Mikrobiologiebefund angepasst wurden, sind der Spezifikation im Kapitel Document Level Template zu entnehmen.
Diese angepassten Elemente umfassen: TODO
- ClincialDocument/templateId
- ClincialDocument/code
- ClinicalDocument/title
- ClinicalDocument/formatCode
- ClinicalDocument/documentationOf/serviceEvent
11.4.3 Section Level Templates
11.4.4 Entry Level Template
11.4.5 Weitere CDA Fragmente
11.5 Terminologien
Die erforderlichen Terminologien sind im Folgenden aufgelistet.
Falls Werte in den definierten Value-Sets fehlen, dann bitten wir um die Meldung mit einem Vorschlag an cda@elga.gv.at.
- ↑ Logical Observation Identifiers Names & Codes (LOINC) loinc.org
- ↑ 2,0 2,1 Regenstrief Institute, Inc. www.regenstrief.org
- ↑ Unified Code for Units of Measure (UCUM) www.unitsofmeasure.org
- ↑ WHO ICD-10 www.who.int/classifications/icd/en/
- ↑ 5,0 5,1 www.who.int
- ↑ Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme 10. Revision – aktuelle Version bitte unter Gesundheitssystem - Krankenanstalten heraussuchen.
- ↑ Anatomical Therapeutic Chemical Classification System (ATC) https://www.who.int/tools/atc-ddd-toolkit/atc-classification
- ↑ ARGE Pharma im Fachverband der chemischen Industrie Österreichs (FCIO) argepharma.fcio.at
- ↑ EDQM Council of Europe www.edqm.eu
- ↑ Health informatics - Medical / health device communication standards ISO/IEEE 11073 Nomenclature Part 10101: Nomenclature
- ↑ Health informatics - Medical / health device communication standards ISO/IEEE 11073 Nomenclature Amendment 1 Part 10101: Nomenclature Amendment 1: Additional Definitions
- ↑ 12,0 12,1 Health Level Seven International www.hl7.org
- ↑ ISO/HL7 27932:2009 Data Exchange Standards — HL7 Clinical Document Architecture, Release 2 [1]
- ↑ World Wide Web Consortium. Extensible Markup Language, 1.0, 5th Edition. [2]
- ↑ HL7 Version 3 Product Suite [3]
- ↑ ART-DECOR® www.art-decor.org
- ↑ 17,0 17,1 HL7 Clinical Document Architecture (CDA) [4]
- ↑ 18,0 18,1 HL7 Version 3: Reference Information Model (RIM) [5]
- ↑ 19,0 19,1 HL7 Version 3 Standard: Data Types – Abstract Specification, Release 2[6]
- ↑ 20,0 20,1 HL7 Templates Standard: Specification and Use of Reusable Information Constraint Templates, Release 1 [7]
- ↑ HL7 Austria www.hl7.at
- ↑ ISO/HL7 27932:2009 Data Exchange Standards — HL7 Clinical Document Architecture, Release 2 [8]
- ↑ World Wide Web Consortium. Extensible Markup Language, 1.0, 5th Edition. [9]
- ↑ HL7 Version 3 Product Suite [10]
- ↑ ART-DECOR® www.art-decor.org
- ↑ HL7 Austria www.hl7.at
- ↑ IHE Patient Care Coordination (PCC) [Online Juli 2019]: https://www.ihe.net/resources/technical_frameworks/#pcc

