Autoren
|
|
Diese Seite oder Abschnitt ist derzeit ein Entwurf und kann sich noch ändern. This article was last edited by Lahnsteiner (talk| contribs) 8 years ago. This article or section is in the middle of an expansion or major restructuring. This article was last edited by Lahnsteiner (talk| contribs) 8 years ago. |
|
|
Dieses Dokument gibt wieder:
Implementierungsleitfaden Laborbefund (2.06.2), OID: n.n., Datum: 20. März 2017, Status: Entwurf. Die Teilmaterialien gehören der Kategorie elga-cdalab-2.06.2 an. |
Implementierungsleitfäden
Laborbefund
Gesundheitswesen [1.2.40.0.34.7.1.6.2]
Inhaltsverzeichnis
- 1 Informationen über dieses Dokument
- 2 Harmonisierung
- 3 Einleitung
1 Informationen über dieses Dokument
1.1 Allgemeines
Ziel dieses Implementierungsleitfadens ist die Beschreibung von Struktur, Format und Standards von medizinischen Dokumenten der Elektronischen Gesundheitsakte "ELGA" gemäß Gesundheitstelematikgesetz 2012 (GTelG 2012), aber auch für medizinische Dokumente im österreichischen Gesundheitswesen.
Die Anwendung dieses Implementierungsleitfadens hat im Einklang mit der Rechtsordnung der Republik Österreich und insbesondere mit den relevanten Materiengesetzen (z.B. Ärztegesetz 1998, Apothekenbetriebsordnung 2005, Krankenanstalten- und Kuranstaltengesetz, Gesundheits- und Krankenpflegegesetz, Rezeptpflichtgesetz, Datenschutzgesetz 2000, Gesundheitstelematikgesetz 2012) zu erfolgen. Technische Möglichkeiten können gesetzliche Bestimmungen selbstverständlich nicht verändern, vielmehr sind die technischen Möglichkeiten im Einklang mit den Gesetzen zu nutzen.
1.2 Sprachliche Gleichbehandlung
Soweit im Text Bezeichnungen nur im generischen Maskulinum angeführt sind, beziehen sie sich auf Männer und Frauen in gleicher Weise. Unter dem Begriff "Patient" werden sowohl Bürger, Kunden und Klienten zusammengefasst, welche an einem Behandlungs- oder Pflegeprozess teilnehmen als auch gesunde Bürger, die derzeit nicht an einem solchen teilnehmen. Es wird ebenso darauf hingewiesen, dass umgekehrt der Begriff Bürger auch Patienten, Kunden und Klienten mit einbezieht.
1.3 Verbindlichkeit
Mit der ELGA-Verordnung 2015 (in der Fassung der ELGA-VO-Nov-2015) macht die Bundesministerin für Gesundheit und Frauen die Festlegungen für Inhalt, Struktur, Format und Codierung verbindlich, die in den Implementierungsleitfäden Entlassungsbrief Ärztlich, Entlassungsbrief Pflege, Pflegesituationsbericht, Laborbefunde, Befund bildgebender Diagnostik, e-Medikation sowie XDS Metadaten (jeweils in der Version 2.06) getroffen wurden. Die anzuwendende ELGA-Interoperabilitätsstufen ergeben sich aus §21 Abs.6 ELGA-VO. Die Leitfäden in ihrer jeweils aktuell gültigen Fassung sowie die aktualisierten Terminologien sind von der Gesundheitsministerin auf www.gesundheit.gv.at zu veröffentlichen. Der Zeitplan zur Bereitstellung der Dokumente für ELGA wird durch das Gesundheitstelematikgesetz 2012 (GTelG 2012) und darauf basierenden Durchführungsverordnungen durch die Bundesministerin für Gesundheit und Frauen vorgegeben.
Die Verbindlichkeit und die Umsetzungsfrist dieses Leitfadens ist im Gesundheitstelematikgesetz 2012, BGBl.I Nr.111/2012 sowie in den darauf fußenden ELGA-Verordnungen geregelt.
Neue Hauptversionen der Implementierungsleitfäden KÖNNEN ab dem Tag ihrer Veröffentlichung durch die Bundesministerin für Gesundheit und Frauen (www.gesundheit.gv.at) verwendet werden, spätestens 18 Monate nach ihrer Veröffentlichung MÜSSEN sie verwendet werden. Andere Aktualisierungen (Nebenversionen) dürfen auch ohne Änderung dieser Verordnung unter www.gesundheit.gv.at veröffentlicht werden.
Die Einhaltung der gesetzlichen Bestimmungen liegt im Verantwortungsbereich der Ersteller der CDA-Dokumente.
1.4 Zielgruppe
Anwender dieses Dokuments sind Softwareentwickler und Berater, die allgemein mit Implementierungen und Integrationen im Umfeld der ELGA, insbesondere der ELGA-Gesundheitsdaten, betraut sind. Eine weitere Zielgruppe sind alle an der Erstellung von CDA-Dokumenten beteiligten Personen, einschließlich der Endbenutzer der medizinischen Softwaresysteme und der Angehörigen von Gesundheitsberufen.
1.5 Hinweis auf verwendete Grundlagen
Der vorliegende Leitfaden wurde unter Verwendung der nachstehend beschriebenen Dokumente erstellt. Das Urheberrecht an allen genannten Dokumenten wird im vollen Umfang respektiert.
Dieser Standard beruht auf der Spezifikation "HL7 Clinical Document Architecture, Release 2.0", für die das Copyright © von Health Level Seven International gilt. HL7 Standards können über die HL7 Anwendergruppe Österreich (HL7 Austria), die offizielle Vertretung von Health Level Seven International in Österreich bezogen werden (www.hl7.at). Alle auf nationale Verhältnisse angepassten und veröffentlichten HL7-Spezifikationen können ohne Lizenz- und Nutzungsgebühren in jeder Art von Anwendungssoftware verwendet werden.
Dieser Leitfaden beruht auf Inhalten des LOINC® (Logical Observation Identifiers Names and Codes, siehe http://loinc.org). Die LOINC-Codes, Tabellen, Panels und Formulare unterliegen dem Copyright © 1995-2014, Regenstrief Institute, Inc. und dem LOINC Committee, sie sind unentgeltlich erhältlich. Lizenzinformationen sind unter http://loinc.org/terms-of-use abrufbar. Weiters werden Inhalte des UCUM® verwendet, UCUM-Codes, Tabellen und UCUM Spezifikationen beruhen auf dem Copyright © 1998-2013 des Regenstrief Institute, Inc. und der Unified Codes for Units of Measures (UCUM) Organization. Lizenzinformationen sind unter http://unitsofmeasure.org/trac/wiki/TermsOfUse abrufbar.
1.6 Danksagung
Die ELGA GmbH weist auf das Dokument „Arztbrief auf Basis der HL7 Clinical Document Architecture Release 2.0 für das deutsche Gesundheitswesen“ hin, welches vom Verband der Hersteller von IT-Lösungen für das Gesundheitswesen (VHitG) herausgegeben wurde. Einige Ausführungen in dem genannten Dokument wurden in das vorliegende Dokument übernommen. Das Urheberrecht an dem Dokument „Arztbrief auf Basis der HL7 Clinical Document Architecture Release 2.0 für das deutsche Gesundheitswesen“, wird im vollen Umfang respektiert.
1.7 Revisionsliste
Diese Version ist eine Nebenversion zur Hauptversion 2.06 und ersetzt diese. Die durchgeführten Änderungen ersehen Sie der Revisionsliste.
1.8 Weitere unterstützende Materialien
Gemeinsam mit diesem Leitfaden werden auf der Website der ELGA GmbH [1] weitere Dateien und Dokumente zur Unterstützung bereitgestellt: Beispieldokumente, zu verwendende Codes, Vorgaben zur Registrierung von CDA-Dokumenten, das Referenz-Stylesheet zur Darstellung von CDA-Dokumenten, Algorithmen zur Prüfung der Konformität von CDA-Dokumenten etc.
Fragen, Kommentare oder Anregungen für die Weiterentwicklung können an cda@elga.gv.at[2] gesendet werden. Weitere Informationen finden Sie unter https://www.elga.gv.at/technischer-hintergrund/technische-elga-leitfaeden.
1.9 Bedienungshinweise für die PDF-Version
Nutzen Sie die bereitgestellten Links im Dokument (z.B. im Inhaltsverzeichnis), um direkt in der PDF-Version dieses Dokuments zu navigieren. Folgende Tastenkombinationen können Ihnen die Nutzung des Leitfadens erleichtern:
- Rücksprung: Alt + Pfeil links und Retour: Alt + Pfeil rechts
- Seitenweise blättern: "Bild" Tasten
- Scrollen: Pfeil nach oben bzw. unten
- Zoomen: Strg + Mouserad drehen
- Suchen im Dokument: Strg + F
1.10 Impressum
Medieneigentümer, Herausgeber, Hersteller, Verleger:
ELGA GmbH, Treustraße 35-43, Wien, Österreich. Telefon: 01. 2127050. Internet: http://www.elga.gv.at.
Email: cda@elga.gv.at.
Geschäftsführer: DI Dr. Günter Rauchegger, DI (FH) Dr. Franz Leisch
Redaktion, Projektleitung, Koordination:
Mag. Dr. Stefan Sabutsch, stefan.sabutsch@elga.gv.at
Abbildungen: © ELGA GmbH
Nutzung: Das Dokument enthält geistiges Eigentum der Health Level Seven® Int. und HL7® Austria, Franckstrasse 41/5/14, 8010 Graz; www.hl7.at.
Die Nutzung ist zum Zweck der Erstellung medizinischer Dokumente ohne Lizenz- und Nutzungsgebühren ausdrücklich erlaubt. Andere Arten der Nutzung und auch auszugsweise Wiedergabe bedürfen der Genehmigung des Medieneigentümers.
Download unter www.gesundheit.gv.at und www.elga.gv.at/technischer-hintergrund/technische-elga-leitfaeden/
2 Harmonisierung
Erarbeitung des Implementierungsleitfadens
Dieser Implementierungsleitfaden entstand durch die Harmonisierungsarbeit der offenen „Arbeitsgruppe Radiologiebefund“ in den Jahren 2008-2012, bestehend aus den unten genannten Personen.
| Autoren | ||
|---|---|---|
| Kürzel | Organisation | Person1 |
| Herausgeber, Projektleiter, CDA Koordinator | ||
| SSA | ELGA GmbH | Stefan Sabutsch |
| Autor, Fachkoordinator, Moderator und Co-Redaktion | ||
| MWE | AIMC GmbH | Martin Weigl |
| AOL | Lindner TAC | Andreas O. Lindner |
| AME | Fachhochschule Technikum Wien | Alexander Mense |
| CGR | HL7 Austria | Christian Gruber |
| Organisation | Person1 | |
|---|---|---|
| Ärztliche Vertreter | ||
| Österreichische Ärztekammer | Franz Frühwald, Hans Mosser, Martin Wehrschütz | |
| Österreichische Röntgengesellschaft | Werner Jaschke | |
| AKH Linz | Thomas Gitter | |
| Sozialmedizinisches Zentrum Ost, Abt. f. Nuklearmedizin | Thomas Leitha | |
| Österreichische Röntgengesellschaft | Thomas Löwe | |
| KAV KH Hietzing Radiologie | Thomas Rand | |
| Unfallkrankenhaus Graz der AUVA | Ulrike Schneider | |
| Steiermärkische Krankenanstaltenges.m.b.H. | Erich Sorantin | |
| Krankenhausträger | ||
| Wiener Krankenanstaltenverbund | Konrad Hölzl | |
| Steiermärkische Krankenanstaltenges.m.b.H. | Markus Pedevilla | |
| Organisationen | ||
| Österreichische Ärztekammer | Gerhard Holler | |
| Bundesfachgruppe Radiologie der österr. Ärztekammer | Brigitte Janisch | |
| Softwarehersteller / Lösungsanbieter | ||
| D.A.T.A. Corporation | Rainer Anzböck, Irene Klein | |
| Philips Healthcare | Walter Auer, R. Schachhuber, Christian Strondl | |
| Systema Human Information Systems GmbH | Thomas Bettstein | |
| AGFA Health Care | Mircea Girlasu | |
| Siemens AG Österreich - Produktmanagement I.S.H.med | Thomas Gitter | |
| Lukas Software | Alfred Lukas | |
| Sustsol - Sustainable Solutions | Karl Rössl | |
| CAS Computer Anwendungssysteme GmbH | Dietmar Ruzicka | |
| Universitäten / Fachhochschulen | ||
| Fachhochschule Technikum Wien | Matthias Frohner, F.Gerbovics, Philipp Urbauer | |
| Patronanz, Akkordierung, Ergänzungen, Zustimmung | ||
|---|---|---|
| Organisation | Person1 | |
| Bundesministerium für Gesundheit | Clemens Auer | |
| ELGA GmbH | Susanne Herbek, Hubert Eisl, Martin Hurch, Oliver Kuttin | |
| OÖ. Gesundheitsfonds | Wolfgang Hießl | |
| Österreichische Ärztekammer | Sabine Manhardt | |
| NÖ Landesklinik Holding | Thomas Pöckl, Alexander Schanner | |
| ITH icoserve technology for healthcare GmbH | Thomas Schabetsberger | |
| Ärztekompetenzzentrum Krems | Andreas Stippler | |
| Andere ELGA Arbeitsgruppen | ||
|---|---|---|
| Bereich | Organisation | Person1 |
| Befundbericht Labor | Fachhochschule Technikum Wien | Stefan Sauermann |
| Entlassungsbrief Arzt und Pflege | CodeWerk Software Services and Development GmbH | Jürgen Brandstätter |
1 Personen sind ohne Titel angegeben
3 Einleitung
3.1 Ausgangssituation
Die Elektronische Gesundheitsakte (ELGA) umfasst die relevanten multimedialen und gesundheitsbezogenen Daten und Informationen zu einer eindeutig identifizierten Person. Die Daten sind in einem oder mehreren computergestützten Informationssystemen gespeichert. Sie stehen allen berechtigten Personen entsprechend ihren Rollen und den datenschutzrechtlichen Bedingungen in einer bedarfsgerecht aufbereiteten elektronischen Form online zur Verfügung.
Die zentrale Anwendung von ELGA ist die Bereitstellung von patientenbezogenen medizinischen Dokumenten, die in vielen unterschiedlichen Informationssystemen der verschiedenen Gesundheitsdiensteanbieter erstellt werden. Diese Dokumente sollen nicht nur von Benutzern gelesen, sondern auch wieder in die IT-Systeme integriert und dort weiterverwendet werden können („Semantische Interoperabilität“). Beispielsweise können für den Arzt aus ELGA-Dokumenten automatisch Warnungen, Erinnerungen, Zusammenfassungen generiert und weitere Informationen berechnet und kontextbezogen angezeigt werden.
Um dieses Ziel zu ermöglichen, wird für Dokumente in ELGA der internationale Standard „Clinical Document Architecture, Release 2.0“ (CDA) von HL7 eingesetzt.
Der CDA-Standard wird für die Verwendung in ELGA im Detail ausspezifiziert, Vorgaben für einheitliche Dokumentation und Codierung der Information festgelegt und in implementierbaren Leitfäden veröffentlicht.
3.2 Zweck
Das vorliegende Dokument enthält die Definition der Inhalte des „Laborbefundes“ für das Österreichische Gesundheitswesen. Diese Spezifikation ist das Resultat einer Harmonisierungsarbeit mit dem Ziel medizinische Befunde, innerhalb der derzeit im Aufbau befindlichen österreichischen „Elektronischen Gesundheitsakte“ (ELGA), als abgestimmte und einheitlich strukturierte Dokumente darzustellen. Das Dokument wurde von einer Arbeitsgruppe von Vertretern der Österreichischen Ärztekammer, von mehreren Krankenhausträgern und Spitälern, Universitäten und Fachgesellschaften, des österreichischen Normeninstitutes, von der Health Level 7 (HL7) Anwendergruppe Österreich, sowie Personen aus der Wirtschaft erstellt. Sowohl angestellte als auch niedergelassene Labormediziner waren massiv an der Erarbeitung beteiligt.
Die Abstimmung erfolgte gemeinsam mit anderen Arbeitsgruppen, die gleichzeitig an den Inhalten für den „Entlassungsbrief“ und den „Befund bildgebende Diagnostik“ arbeiten. Vor allem die Informationen über die betroffenen und handelnden Personen, Zeitangaben, Dokumentart und ähnliches im so genannten „Header“ wurden eng abgestimmt und im Rahmen eines zentralen Dokumentes „Allgemeiner Implementierungsleitfaden für ELGA CDA Dokumente [OID Root 1.2.40.0.34.7.1]“ [4] definiert.
Der Header enthält zum einen administrative Daten (allgemeine Angaben zum Dokument, Daten zum Patienten, usw.) und dient zum anderen zum Teil auch als Quelle für die Metadaten, die bei der Registrierung des Dokuments in ELGA verwendet werden. Der Header wurde über alle Anwendungsbereiche der ELGA einheitlich abgestimmt.
Die medizinisch relevanten Anteile sind im so genannten „Body“ enthalten. Die vorliegende Spezifikation der laborspezifischen Inhalte eines Labordokuments in ELGA wurde von der Expertengruppe beruhend auf einer Liste mit Vorgaben der österreichischen Gesellschaft für Labormedizin und klinische Chemie (ÖGLMKC) erstellt.
Als technische Basis dient das „Laboratory Technical Framework Volume 3 (LAB TF-3) Revision 3.0, 2011“ ([3]) der “Integrating the Healthcare Enterprise” (IHE).
Das Verständnis eines „Laborbefundes“ erstreckt sich in diesem Dokument über das gesamte Spektrum der laboranalytisch ermittelten Befunde. Die vorliegende Version definiert grundlegende Anforderungen für die Erstellung von Laborbefunden als CDA Dokumente. Insbesondere wurden Laborbefunde aus der Klinischen Chemie, Hämatologie, Immunchemie und Mikrobiologie/Bakteriologie in die Überlegungen mit einbezogen. Die gewählten Strukturen ermöglichen prinzipiell eine Übermittlung des gesamten Befundspektrums des Laborbereiches, jedoch sind die einzelnen Detailbereiche in folgenden Arbeiten detailliert zu analysieren, abzustimmen und für weitere Laborbefundarten zu definieren. Es existieren vielmehr auch dezidierte Bereiche - wie z.B. die Transfusionsmedizin – für die die Definitionen dieses Leitfadens aufgrund fehlender Strukturen und nicht definierter Codelisten nicht ausreichend sind. Dieser Leitfaden verwendet „Analysen“ als Sammelbegriff für Laboruntersuchungen, Laborleistungen und Labormessgrößen.
3.3 Vorgaben zum medizinischen Inhalt
3.3.1 Allgemeiner Laborbefund
Die inhaltlichen Definitionen beruhen auf den Mindestvorgaben der österreichischen Gesellschaft für Labormedizin und klinischen Chemie (ÖGLMKC) und wurden weiter verfeinert. Die nachfolgende Tabelle zeigt einen Überblick über die inhaltlich abzubildenden medizinisch relevanten Daten.
| Feld | Beschreibung | Bereich |
|---|---|---|
| Allgemeine Befundinformationen | ||
| Zeitpunkt der Auftragserfassung | Datum und Zeitpunkt, an dem das analysierende Labor die Anforderung vom Zuweiser in der Labor EDV erfasst hat | Header |
| Auftragsdiagnose (Zuweiserdiagnose) | Vom Auftraggeber bestimmte und dem Labor übermittelte Verdachtsdiagnose | Body |
| Fragestellung | Vom Auftraggeber übermittelte Fragestellung | Body |
| Befundtext | Kommentar zum gesamten Befund | Body |
| Spezimeninformation | ||
| Zeitpunkt der Spezimengewinnung | Damit ist jenes Datum und Zeitpunkt gemeint, an dem das Spezimen zur Analyse gewonnen wurde. Die Dokumentation des Zeitpunkts der Spezimengewinnung ist in der Verantwortung der entnehmenden Person, die in vielen Fällen mit dem Befundersteller nicht identisch ist, da meist Spezimen zur Analyse an Labors versendet werden. Daher ist der Zeitpunkt vielfach im Labor nicht feststellbar. | Body |
| Zeitpunkt des Einlangens des Spezimen | Datum und Zeit der Probenannahme im Labor | Body |
| Art des Spezimens (Specimen Type) | Art der Probe (=Materialart) | Body |
| Entnahmeort | Angabe der Körperstelle, von der das Spezimen stammt | Body |
| Entnahmeart (SpecimenCollectionProcedure) | Art der Gewinnung | Body |
| Specimen ID | Eindeutige Nummer des Spezimen | Body |
| Entnehmende Person (Performer) | Person, welche die Entnahme der Probe durchgeführt hat | Body |
| Kommentar zum Spezimen | Präanalytik pro Spezimen zur Spezimenqualität | Body |
| Allgemeine Anmerkungen des Labors zur Spezimenqualität | Textinformationen zur Spezimenqualität | Body |
| Allgemeine Laborergebnisse | ||
| Gruppierung / Befundgruppen (Organizer) | Analysengruppierung | Body |
| ID des Tests | Eindeutige Codierung des Tests | Body |
| Analysenbezeichnung | Bezeichnung der Analyse (aus dem Value Set ELGA_Laborparameter) |
Body |
| Ergebnis | Body | |
| Einheit | Body | |
| Referenzbereiche | Für die Beurteilung relevante Referenzwerte. Die Angabe mehrerer Referenzbereiche zu einem Test ist möglich. | Body |
| Befundinterpretation | Codierte Bewertung des Ergebnisses | Body |
| Deltacheck | Tendenzielle Veränderung zu Vorwerten | Body |
| Ergebniskommentar | Kommentar des Labors zu einem einzelnen Testergebnis | Body |
| Externes Labor | Kennzeichen ob ein Ergebnis extern ermittelt wurde | Body |
| Bakteriologische Ergebnisse | ||
| Analysen | Body | |
| Erreger2 (Isolate) | Body | |
| Antibiotischer Wirkstoff | Body | |
| Resistenzkennung | Codierte Bewertung der Resistenz (R,S,I) | Body |
Tabelle 1: Im Laborbefund abzubildende medizinische Daten
2 Erreger oder Krankheitserreger sind Stoffe oder Organismen, die in anderen Organismen potenziell gesundheitsschädigende Abläufe verursachen können.
3.3.2 Mikrobiologische Befunde
Unter den Analysen eines Laborbefunds finden sich viele aus dem Bereich der Mikrobiologie. Dieser Teil des Leitfadens beschäftigt sich mit den mikrobiologischen Methoden und Analysen im Labor, die sich nicht über die „klassische“ Struktur eines Laborbefundes darstellen lassen. Dies betrifft hauptsächlich die Bakteriologie zum Nachweis von Bakterien, z.B. mit der Darstellung von Keimwachstum, Koloniebeschreibung und Antibiogrammen. Die Strukturierung des mikrobiologischen Befundes folgt einem bestimmten Muster, das den Untersuchungsverlauf widerspiegelt: Beschreibung des entnommenen Materials (z.B. Mittelstrahlharn), die direkt untersuchten Eigenschaften des Materials (z.B. Farbe), mikroskopische Untersuchung des Materials (z.B. Erythrozyten, Leukozyten, grampositive Bakterien). Falls Bakterienwachstum festgestellt wird, folgt eine Beschreibung der Kulturen, eine Benennung der Reinkulturen (Isolate) mit Nennung der taxonomischen Bestimmung der Mikroorganismen (z.B. Streptococcus pyogenes) ggf. mit Angabe des Serovars/Pathovars. Meist wird ein Antibiogramm angefügt. Es kann auch eine minimale Hemmkonzentration (MHK) enthalten sein.
Dementsprechend ist folgende hierarchische Struktur abzubilden:
Zur Kennzeichnung des Mikrobiologiebefundes über die ServiceEvents siehe Kapitel Spezielle Vorgaben.
3.4 Hierarchie der Implementierungsleitfäden
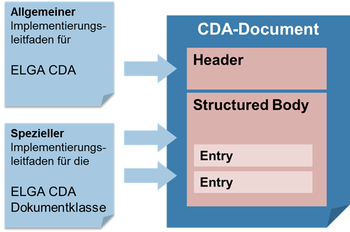
Der vorliegende Implementierungsleitfaden basiert auf dem „Allgemeinen Implementierungsleitfaden“, der grundlegenden Implementierungsvorschrift für alle CDA Dokumente im österreichischen Gesundheitswesen [4]. Der CDA “Laborbefund“ hat grundsätzlich beiden aufeinander aufbauenden Implementierungsleitfäden zu folgen.
Die administrativen Daten im Dokumentheader und grundsätzliche Vorgaben für den medizinischen Inhalt werden vom „Abbildung 1: Allgemeinen Implementierungsleitfaden“ definiert. Der jeweilige „Spezielle Implementierungsleitfaden“ enthält die Vorgaben für die medizinischen Inhalte und ergänzt gegebenenfalls die Header-Vorgaben.
Für die Verwendung dieses Implementierungsleitfadens sind zusätzlich die Vorgaben aus
„HL7 Implementation Guide for CDA® R2: Allgemeiner Implementierungsleitfaden für ELGA CDA Dokumente“ [OID Root 1.2.40.0.34.7.1]
in der Hauptversion 2 vorausgesetzt.
3.5 Verweis auf den Allgemeinen Leitfaden
Verweis auf den Allgemeinen Leitfaden:
Die Elemente erfordern keine speziellen Vorgaben. Es gelten die Vorgaben der entsprechenden Kapitel des „Allgemeinen Implementierungsleitfadens“.
3.6 Menschenlesbar vs. maschinenlesbar: CDA Level 2 oder Level 3
CDA-Dokumente müssen grundsätzlich für menschliche Betrachter lesbar sein. Das gilt für sämtliche Inhalte, so wie sie vom Ersteller signiert worden sind. Technisch ist das über den so genannten CDA Text Level („Level 1“) und Section Level („Level 2“) umgesetzt.
Zusätzlich können CDA-Dokumente auch codierte Teile enthalten, die für die automatisierte maschinelle Weiterverarbeitung gedacht sind, etwa zur automatischen Erstellung von Zeitverläufen über Ergebnisse aus mehreren, zu verschiedenen Zeitpunkten erstellten Befunden. Die maschinenlesbaren Teile werden technisch im so genannten CDA Entry Level („Level 3“) Teil des Befundes abgelegt.
Dabei gelten folgende Regelungen, um sicherzustellen, dass der menschenlesbare Teil und der maschinenlesbare Teil keine widersprüchlichen Daten enthalten: Als verbindlich gelten die menschenlesbaren Inhalte, die im „Level 2“ dargestellt sind.
Für ELGA Laborbefunde gilt, dass, sollte eine Sektion maschinenlesbare Inhalte codieren, der meschenlesbare Inhalt des Dokuments vollständig aus den codierten Inhalten erzeugt werden kann. Dies bedeutet, dass sämtliche Informationen in einer Sektion sowohl maschinenlesbar als auch menschenlesbar vorliegen.
Der menschenlesbare Teil kann daher keine Daten enthalten, die im maschinenlesbaren Teil nicht enthalten sind.
3.7 IHE Konformität
3.7.1 Referenz
Der vorliegende Leitfaden baut auf den Definitionen des „Laboratory Technical Framework Volume 3 (LAB TF-3) Revision 3.0, 2011“ [3] auf, welche durch diesen Leitfaden weiter eingeschränkt werden. Dadurch erhalten die entsprechenden Templates ihre Gültigkeit und sind aus Konformitätsgründen bei Komponenten, welche über eine entsprechende Definition verfügen, auch anzugeben.
3.7.2 Angabe der Adresse und Telefonnummer
Entsprechend den Vorgaben des IHE Frameworks für Labor sind für Personen und Organisationen die Angabe einer Adresse (addr-Element) und Telekom Verbindung (telecom-Element) verpflichtend. Diese können jedoch mit einem nullFlavor versehen werden.