ILF:Patient Summary
|
|
Diese Seite oder Abschnitt ist derzeit ein Entwurf und kann sich noch ändern. This article was last edited by Leder (talk| contribs) 6 years ago. This article or section is in the middle of an expansion or major restructuring. This article was last edited by Leder (talk| contribs) 6 years ago. |
|
|
Dieses Dokument gibt wieder:
Implementierungsleitfaden Patient Summary (V0.01), OID: 1.2.40.0.34.7.16.1, Datum: 20. März 2017, Status: Entwurf. Die Teilmaterialien gehören der Kategorie elga-cdaps-2.06.2 an. |
Implementierungsleitfäden
Patient Summary
Gesundheitswesen [1.2.40.0.34.7.16.1]
Wichtige Lizenzinformationen
Die von HL7 Austria erarbeiteten Standards und die Bearbeitungen der Standards von HL7 International stellen Werke im Sinne des österreichischen Urheberrechtsgesetzes dar und unterliegen daher urheberrechtlichem Schutz.
HL7 Austria genehmigt die Verwendung dieser Standards für die Zwecke der Erstellung, des Verkaufs und des Betriebs von Computerprogrammen, sofern nicht anders angegeben oder sich die Standards auf andere Urheber- oder Lizenzrechtlich geschützte Werke beziehen.
Die vollständige oder teilweise Veröffentlichung der Standards (zum Beispiel in Spezifikationen, Publikationen oder Schulungsunterlagen) ist nur mit einer ausdrücklichen Genehmigung der HL7 Austria gestattet. Mitglieder von HL7 Austria sind berechtigt, die Standards vollständig oder in Auszügen ausschließlich organisationsintern zu publizieren, vervielfältigen oder verteilen.
Die Veröffentlichung eigener Anpassungen der HL7-Spezifikationen (im Sinne von Lokalisierungen) oder eigener Leitfäden erfordert eine formale Vereinbarung mit der HL7 Austria.
Die vollständigen Lizenzinformationen finden sich unter https://hl7.at/nutzungsbedingungen-und-lizenzinformationen/
Die Lizenzbedingungen von HL7 International finden sich unter http://www.HL7.org/legal/ippolicy.cfm
Urheberrechte und Nutzungsrechte von anderen Quellen (“Third Party IP”):
Der Nutzer dieses Dokuments (bzw. der Lizenznehmer) stimmt zu und erkennt an, dass HL7 Austria nicht alle Rechte und Ansprüche in und an den Materialien besitzt und dass die Materialien geistiges Eigentum von Dritten enthalten und / oder darauf verweisen können ("Third Party IP").
Die Anerkennung dieser Lizenzbestimmungen gewährt dem Lizenznehmer keine Rechte in Bezug auf Drittanbieter-IP. Der Lizenznehmer allein ist für die Identifizierung und den Erhalt von notwendigen Lizenzen oder Genehmigungen zur Nutzung von "Third Party IP" im Zusammenhang mit den Materialien oder anderweitig verantwortlich.
Jegliche Handlungen, Ansprüche oder Klagen eines Dritten, die sich aus einer Verletzung eines "Third Party IP"-Rechts durch den Lizenznehmer ergeben, bleiben die Haftung des Lizenznehmers.
Im Folgenden finden Sie eine Liste von Terminologien (ohne Anspruch auf Vollständigkeit), die eine solche separate Lizenz erfordern können:
| Terminologie | Eigentümer, Kontaktinformation |
|---|---|
| SNOMED CT | International Healthcare Terminology Standards Development Organization (IHTSDO)
http://www.ihtsdo.org/snomed-ct/get-snomed-ct or info@ihtsdo.org |
| Logical Observation Identifiers Names & Codes (LOINC) | Regenstrief Institute, Inc.] |
| Unified Code for Units of Measure (UCUM) | Regenstrief Institute, Inc.] |
| International Classification of Diseases (ICD) | World Health Organization (WHO) |
| International Classification of Diseases (ICD-10) BMGF | Bundesministerium für Gesundheit und Frauen |
| Anatomical Therapeutic Chemical Classification System (ATC) | World Health Organization (WHO) |
| Pharmazentralnummer (PZN) | ARGE Pharma im Fachverband der chemischen Industrie Österreichs (FCIO) der Wirtschaftskammern Österreichs (WKO) |
Inhaltsverzeichnis
- 1 Übersicht
- 2 Einleitung
- 3 Informationen über dieses Dokument
- 4 Technischer Hintergrund
- 5 Grundsätze und Regeln
- 5.1 Allgemeines
- 5.2 Annahmen
- 5.3 Umgang mit codierten Informationen und Terminologien
- 5.4 Mehrsprachigkeit
- 5.5 Herkunft der Information
- 5.6 Zeitangaben
- 6 Anhang
1 Übersicht
Das ist der Implementierungsleitfaden für das Österreichische Patient Summary Dokument. Die Vorgaben beruhen auf dem HL7 Leitfaden für das Internationale Patient Summary (HL7 IPS) und sind kompatibel mit den Vorgaben für das Patient Summary für den grenzüberschreitenden Datenaustausch (EU eHealth Network)
2 Einleitung
2.1 Definition
Das Patient Summary soll zur sicheren und zuverlässigen Gesundheitsversorgung beitragen, sowohl im Fall von unerwarteten oder ungeplanten Behandlungen (Unfall, Notfall), als auch bei geplanten Behandlungen und bei der grenzüberschreitenden Gesundheitsversorgung.
Ein Patient Summary enthält allgemeine demografische Daten des Patienten (z.B. Name, Geburtsdatum, Geschlecht), eine Zusammenfassung der für die weitere medizinische Behandlung wesentlichen Erkenntnisse und Inhalte aus den Krankenakten des Patienten (z.B. aktuelle medizinische Probleme, Allergien, größere chirurgische Eingriffe, medizinische Implantate) sowie die aktuelle Medikation.
- Übersichtstabelle der administrativen Daten des Patient Summary
- Übersichtstabelle der medizinischen Inhalte des Patient Summary
2.2 Zweck
Ziel des Patient Summary ist es
- dem GDA einen schnellen Überblick über die (in ELGA) verfügbaren Informationen zu einem Patienten zu ermöglichen
- die wesentlichen Gesundheitsinformationen eines Patienten eindeutig und hochstrukturiert zu dokumentieren und in andere Sprachen übersetzbar zu machen
2.3 Umfang
Das Patient Summary ist
- ein minimaler und nicht-vollständiger Datensatz,
- geeignet für alle medizinischen Fachrichtungen und Gesundheitseinrichtungen,
- unabhängig von der aktuellen Situation des Patienten,
- für die grenzüberschreitende Gesundheitsversorgung vorgesehen.
Das Patient Summary ist daher keine vollständige Krankenakte, sondern eine Zusammenfassung. "Minimaler und nicht-vollständiger Datensatz" bedeutet, dass nur ein Teil der Krankengeschichte im Patient Summary dokumentiert wird. Es soll den eigentlichen Gesundheitszustand des Patienten repräsentieren und nicht die Historie abbilden. Es ist unabhängig von der medizinischen Fachrichtung oder dem Typ der Gesundheitseinrichtung.
2.4 Zielgruppe
Anwender dieses Dokuments sind Softwareentwickler und Berater, die allgemein mit Implementierungen und Integrationen im Umfeld der ELGA, insbesondere der ELGA-Gesundheitsdaten, betraut sind. Eine weitere Zielgruppe sind alle an der Erstellung von CDA-Dokumenten beteiligten Personen, einschließlich der Endbenutzer der medizinischen Softwaresysteme und der Angehörigen von Gesundheitsberufen.
2.5 Beziehung zu anderen Projekten und Leitfäden
Das Österreichische Patient Summary soll über die Elektronische Gesundheitsakte ELGA zur Verfügung stehen [www.elga.gv.at]. Für Bürger, die auch ELGA-Teilnehmer sind, kann ein Patient Summary erzeugt werden und über das ELGA-Portal angesehen werden. Ihre behandelnden ELGA-Gesundheitsdiensteanbieter sollen darauf zugreifen dürfen.
Das Österreichische Patient Summary soll auch für den grenzüberschreitenden Datenaustausch zur Verfügung stehen, wenn der ELGA-Teilnehmer dies möchte (EU eHealth Network). Das EU-Projekt "eHealth Digital Service Infrastructure" (eHDSI) hat zum Ziel, dass EU Bürger ihre "Patient Summaries" und "ePrescriptions" (elektronische Rezepte) auch in anderen Ländern der EU verwenden können. Österreich soll ab 2020 an dieses Netzwerk angeschlossen werden.
Die Vorgaben dieses Leitfaden beruhen auf dem HL7 Leitfaden für das Internationale Patient Summary (HL7 IPS) sowie auf den allgemeinen Vorgaben für ELGA CDA Dokumente (Allgemeiner Implementierungsleitfaden). Wo das möglich war, wurden auch Vorgaben aus anderen bestehenden ELGA CDA Implementierungsleitfäden, wie dem Leitfaden für den Ärztlichen Entlassungsbrief, den Pflegerischen Entlassungsbrief und der e-Medikation wiederverwendet.
2.6 Hinweise zur Verwendung
Dieser Leitfaden ist derzeit ein Abstimmungsdokument, d.h. er wird technisch und inhaltlich noch abgestimmt. Kommentare können an office@hl7.at gesendet werden.
Geben Sie bitte eine exakte Beschreibung des Problems und die Stelle im Dokument an. Dazu gibt es in der PDF-Version am linken Seitenrand eine Skale, die Sie mit der Kapitel- und Seitennummer angeben.
3 Informationen über dieses Dokument
3.1 Allgemeines
Ziel dieses Implementierungsleitfadens ist die Beschreibung von Struktur, Format und Standards von medizinischen Dokumenten der Elektronischen Gesundheitsakte "ELGA" gemäß Gesundheitstelematikgesetz 2012 (GTelG 2012), aber auch für medizinische Dokumente im österreichischen Gesundheitswesen.
Die Anwendung dieses Implementierungsleitfadens hat im Einklang mit der Rechtsordnung der Republik Österreich und insbesondere mit den relevanten Materiengesetzen (z.B. Ärztegesetz 1998, Apothekenbetriebsordnung 2005, Krankenanstalten- und Kuranstaltengesetz, Gesundheits- und Krankenpflegegesetz, Rezeptpflichtgesetz, Datenschutzgesetz 2000, Gesundheitstelematikgesetz 2012) zu erfolgen. Technische Möglichkeiten können gesetzliche Bestimmungen selbstverständlich nicht verändern, vielmehr sind die technischen Möglichkeiten im Einklang mit den Gesetzen zu nutzen.
3.2 Sprachliche Gleichbehandlung
Soweit im Text Bezeichnungen nur im generischen Maskulinum angeführt sind, beziehen sie sich auf Männer und Frauen in gleicher Weise. Unter dem Begriff "Patient" werden sowohl Bürger, Kunden und Klienten zusammengefasst, welche an einem Behandlungs- oder Pflegeprozess teilnehmen als auch gesunde Bürger, die derzeit nicht an einem solchen teilnehmen. Es wird ebenso darauf hingewiesen, dass umgekehrt der Begriff Bürger auch Patienten, Kunden und Klienten mit einbezieht.
3.3 Verbindlichkeit
Mit der ELGA-Verordnung 2015 (in der Fassung der ELGA-VO-Nov-2015) macht die Bundesministerin für Gesundheit und Frauen die Festlegungen für Inhalt, Struktur, Format und Codierung verbindlich, die in den Implementierungsleitfäden Entlassungsbrief Ärztlich, Entlassungsbrief Pflege, Pflegesituationsbericht, Laborbefunde, Befund bildgebender Diagnostik, e-Medikation sowie XDS Metadaten (jeweils in der Version 2.06) getroffen wurden. Die anzuwendende ELGA-Interoperabilitätsstufen ergeben sich aus §21 Abs.6 ELGA-VO. Die Leitfäden in ihrer jeweils aktuell gültigen Fassung sowie die aktualisierten Terminologien sind von der Gesundheitsministerin auf www.gesundheit.gv.at zu veröffentlichen. Der Zeitplan zur Bereitstellung der Dokumente für ELGA wird durch das Gesundheitstelematikgesetz 2012 (GTelG 2012) und darauf basierenden Durchführungsverordnungen durch die Bundesministerin für Gesundheit und Frauen vorgegeben.
Die Verbindlichkeit und die Umsetzungsfrist dieses Leitfadens ist im Gesundheitstelematikgesetz 2012, BGBl.I Nr.111/2012 sowie in den darauf fußenden ELGA-Verordnungen geregelt.
Neue Hauptversionen der Implementierungsleitfäden KÖNNEN ab dem Tag ihrer Veröffentlichung durch die Bundesministerin für Gesundheit und Frauen (www.gesundheit.gv.at) verwendet werden, spätestens 18 Monate nach ihrer Veröffentlichung MÜSSEN sie verwendet werden. Andere Aktualisierungen (Nebenversionen) dürfen auch ohne Änderung dieser Verordnung unter www.gesundheit.gv.at veröffentlicht werden.
Die Einhaltung der gesetzlichen Bestimmungen liegt im Verantwortungsbereich der Ersteller der CDA-Dokumente.
3.4 Harmonisierung
Dieser Implementierungsleitfaden entstand durch die Harmonisierungsarbeit der "Arbeitsgruppe Patient Summary", die im Zeitraum von September 2016 bis August 2017 tagte. Die Teilnehmer der Arbeitsgruppe sind delegiert durch ihre Organisation und vertreten diese.
Die Arbeitsgruppe harmonisierte primär die inhaltlichen Vorgaben und soweit möglich die zu verwendenden Terminologien (Value Sets). Die Formulierung der technischen Spezifikation des CDA Implementierungsleitfadens Patient Summary erfolgte im Auftrag der ELGA GmbH parallel bzw. nach der inhaltlichen Festlegung.
Der Leitfaden wird in einem technischen Abstimmungsverfahren durch die HL7 Austria ("Ballot") zu einem österreichischen Standard. Eine Verordnung des Bundesministeriums kann eine Verbindlichkeit zur Anwendung begründen.
3.5 Autoren und Mitwirkende
3.5.1 Autoren
Das Redaktionsteam bestand aus folgenden Personen:
| Name | Organisation | |
|---|---|---|
| Mag. Dr. Stefan Sabutsch | ELGA GmbH, HL7 Austria | Herausgeber, Autor |
| DI Sonja Leder | Sigma Software Solutions OG | Autor |
| DI Silvia Winker, MSc. | Sigma Software Solutions OG | Autor |
3.5.2 Mitwirkende
Teilnehmer der Arbeitsgruppe Patient Summary Im Zeitraum 2016-2017: Dr. Gabriele Aicher (AKH Wien), Mag.Johannes Ambros (Humanomed IT Solutions Gmbh), Karl Blauensteiner (Gesundheitsverbund WGKK), Dr. Klaus Buttinger (Gespag), Adis Buturovic (AKH Wien), Christian Chvosta (Vinzenz Gruppe), Dr. Christoph Dachs (ÖGAM), Veronika Daxner (ITH Icoserve), Dr. Stefan Dorner, MBA (Wiener Krankenanstaltenverbund (KAV)), DI Reinhard Egelkraut (CGM Clinical Österreich GmbH), Dr. Brigitte Erlacher (Vinzenz Gruppe), Ingrid Fehervary (Wiener Krankenanstaltenverbund (KAV)), Ing. Mag. Udo Feyerl (OÖ Gebietskrankenkasse), Bernd Fischer (ITH Icoserve), Ing. Victor Emanuel Grogger (KAGES), Helga Gruber (ÖÄK), Dr. Ludwig Gruber (ÄK Tirol), Josef Hamedinger (Gespag), DI Sandra Heissenberger (Stadt Wien, Magistratsdirektion), Emmanuel Helm MSc (FH Oberösterreich), Dr. Susanne Herbek (ELGA GmbH), Ing. Wolfgang Hießl, MSc, MBA (OÖGesFonds), Florian Hoffmann (VAEB Institut für Gesundheitsförderung und Prävention GmbH (IfGP) ), Karl Holzer (CGM), Mag. Konrad Hölzl (KAV Wien), Michael Hubich (Barmh. Schwestern), Dr. Christian Husek (Initiative ELGA), Dr. Silvester Hutgrabner (ÖÄK), Reinhold Igler (AKH Wien), Dr. Christina Kastner-Frank (AKH Wien), Dietmar Keimel (CAS), Alexander Keller (Vinzenz Gruppe), Mag. Martin Keplinger (ÖÄK), DI Andrea Klostermann (ELGA GmbH), Dr. Harald Kornfeil (Ordination Dr. Kornfeil), Brigitte Lagler, MSc (Herz-Jesu Krankenhaus; ÖGKV), Cornelia Lahnsteiner (ELGA GmbH), Assoc.Prof.PD.Dr. Felix Langer (AKH Wien), DI Sonja Leder (SigmaSoft), DI Christian Ledl (A1 Telekom Austria ), Cornelia Lindner (ELGA GmbH), Mag. Herwig Loidl, MBA MSc (CareCenter Software GmbH), Patrick Mangesius (ITH Icoserve), Dr. Stefan Marlovits (PremiQaMed), DI Alexander Mense (HL7 Austria), Ing. Mag. (FH) Jan Nicolics (A1 Telekom Austria ), DI Michael Nöhammer (ÖÄK), Roland Novak (SALK), DI Dr. Markus Pedevilla, MSc (KAGES), Lucas Pflanzl, BSc (Institut für Gesundheitsförderung und Prävention GmbH), Mag. Theresa Philippi (ELGA GmbH), Mag. Barbara Philipp-Jaschek, MBA (AKH Wien), Dr. Susanne Rabady (ÖGAM), Dr. Günter Rauchegger (ELGA GmbH), DI Dr. Stefan Rausch-Schott (Vinzenz Gruppe), Dr. Stefan Sabutsch (ELGA GmbH), Dr. Stefan Sauermann (FH Technikum Wien), Michaela Schaller (ÖGKV), Ing. Eduard Schebesta (HCS), Dr. Christian Scheibböck (AKH Wien), DI Herbert Scheiber (Humanomed IT Solutions Gmbh), Markus Schell (Wiener Krankenanstaltenverbund (KAV)), Dr. Michael Schriefl (ÖÄK), Univ.-Prof. Dr.med. Stefan Schulz (MedUni Graz), Dipl.-Ing. Hans-Jörg Seeburger (Atos), Carina Seerainer (ELGA GmbH), DI Dr. Peter Seifter (HL7 / FH Joanneum), Dr.Adolf Sonnleitner (Fabasoft Austria Gmbh), Ing. Mag. (FH) Mag. Christian Stark (Tirol-Kliniken), OA Mag. Dr.med. Günther Stark (Kages), Dr. Lukas Stärker (Österr. Ärztekammer), Doris Steiner (CGM Arztsysteme Österreich), Friederike Stewig (GÖG), Gerhard Stimac (CGM), Mag. Elisabeth Strahser (WKO Fachverband Unternehmensberatung), Univ. Prof. Dr. Zsolt Szépfalusi (MedUni Wien), DI Herlinde Toth (KAV Wien), Dipl.-Ing. (FH) Kathrin Trunner, MSc (BMGF), Ing. Christoph Unfried (HCS), Dr. Burkhard Walla (ÖÄK), Ing. Norbert Weber (WEBMED, Weber GmbH & Co KG), Dr. Irina Weik (BMGF), DI Silvia Winkler, MSc (SigmaSoft), Dr. Petra Ziegelmayer (ÖGAI, Allergiezentrum Wien West)
Review-Beiträge von: - noch keine Reviews -
3.6 Hinweis auf verwendete Grundlagen
Der vorliegende Leitfaden wurde unter Verwendung der nachstehend beschriebenen Dokumente erstellt. Das Urheberrecht an allen genannten Dokumenten wird im vollen Umfang respektiert.
Dieser Standard beruht auf der Spezifikation "HL7 Clinical Document Architecture, Release 2.0", für die das Copyright © von Health Level Seven International gilt. HL7 Standards können über die HL7 Anwendergruppe Österreich (HL7 Austria), die offizielle Vertretung von Health Level Seven International in Österreich bezogen werden (www.hl7.at). Alle auf nationale Verhältnisse angepassten und veröffentlichten HL7-Spezifikationen können ohne Lizenz- und Nutzungsgebühren in jeder Art von Anwendungssoftware verwendet werden.
Dieser Leitfaden beruht auf Inhalten des LOINC® (Logical Observation Identifiers Names and Codes, siehe http://loinc.org). Die LOINC-Codes, Tabellen, Panels und Formulare unterliegen dem Copyright © 1995-2014, Regenstrief Institute, Inc. und dem LOINC Committee, sie sind unentgeltlich erhältlich. Lizenzinformationen sind unter http://loinc.org/terms-of-use abrufbar. Weiters werden Inhalte des UCUM® verwendet, UCUM-Codes, Tabellen und UCUM Spezifikationen beruhen auf dem Copyright © 1998-2013 des Regenstrief Institute, Inc. und der Unified Codes for Units of Measures (UCUM) Organization. Lizenzinformationen sind unter http://unitsofmeasure.org/trac/wiki/TermsOfUse abrufbar.
3.7 Weitere unterstützende Materialien
Gemeinsam mit diesem Leitfaden werden auf der Website der ELGA GmbH (www.elga.gv.at/CDA) weitere Dateien und Dokumente zur Unterstützung bereitgestellt:
- Beispieldokumente
- Referenz-Stylesheet (Tool zur Darstellung im Browser - Konvertierung in HTML)
- CDA2PDF Suite (Tool zur Erzeugung einer PDF-Datei zur Ausgabe am Drucker)
- Schematron-Dateien für die Prüfung der Konformität ("Richtigkeit") von CDA Dateien
- Vorgaben zur Registrierung von CDA-Dokumenten (Leitfaden für XDS-Metadaten)
- Hinweise für die zu verwendenden Terminologien
- Leitfaden zur richtigen Verwendung von Terminologien
Fragen, Kommentare oder Anregungen für die Weiterentwicklung können an cda@elga.gv.at gesendet werden. Weitere Informationen finden Sie unter www.elga.gv.at/CDA.
4 Technischer Hintergrund
4.1 Hierarchie der Implementierungsleitfäden
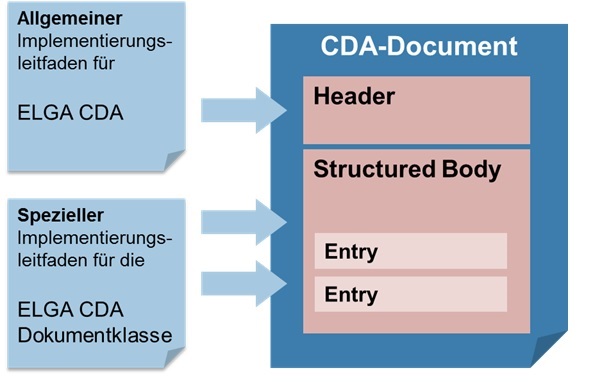
Der vorliegende Implementierungsleitfaden basiert auf der grundlegenden Implementierungsvorschrift für alle CDA Dokumente im österreichischen Gesundheitswesen.
Das CDA Dokument "Patient Summary" hat grundsätzlich beiden aufeinander aufbauenden Implementierungsleitfäden zu folgen.
Die administrativen Daten im Dokumentheader und grundsätzliche Vorgaben für den medizinischen Inhalt werden vom "Allgemeinen Implementierungsleitfaden" definiert. Der jeweilige "Spezielle Implementierungsleitfaden" enthält die Vorgaben für die medizinischen Inhalte und ergänzt gegebenenfalls die Header-Vorgaben.
| Für die Verwendung dieses Implementierungsleitfadens sind zusätzlich die Vorgaben aus "HL7 Implementation Guide for CDA® R2: Allgemeiner Implementierungsleitfaden für ELGA CDA Dokumente" [OID Root 1.2.40.0.34.7.1] |
4.2 Weitere Inhalte
- Allgemeine Informationen zu CDA
- CDA Templates
- Art-Decor-Tabellen verstehen
- Technische Konformitätsprüfung
- Identifikatoren
- Terminologien
elga-cdaps-2.06.2:Anwendungsfälle
5 Grundsätze und Regeln
5.1 Allgemeines
Dieses Dokument spezifiziert eine HL7 CDA R2 Implementierung, ist aber in den Grundzügen kompatibel mit dem in Entwicklung befindlichen FHIR-Standard. In einigen Fällen folgt es eher der FHIR Stilistik, um Konzepte zu repräsentieren und weicht daher von der in CDA bzw HL7 Version 3 üblichen Art ab. Das betrifft hauptsächlich die Mechanismen für Negation, unbekannte und fehlende Informationen (NullFlavors).
Um grenzüberschreitend austauschbar und verständlich zu sein, muss das Patient Summary so weit wie möglich auf strukturierte Daten und mehrsprachige internationale Referenzterminologien stützen, die für das Patient Summary ohne Kosten für die globale Nutzung lizenziert werden.
Im Falle von SNOMED CT wird erwartet, dass die IHTSDO (SNOMED International) und die Republik Österreich, vertreten durch das Bundesministerium für Gesundheit und Frauen, eine Vereinbarung treffen werden, um den Einsatz von SNOMED CT für den Einsatz in Österreich zu ermöglichen. In diesem Sinne wird SNOMED CT als bevorzugte Terminologie und für die Mehrheit der Wertmengen (Value Sets) verwendet.
Andere bevorzugte Terminologien, die in dieser Spezifikation verwendet werden, sind LOINC für Beobachtungen (z.B. Labortests) und Dokumentabschnitte (Sections), UCUM für Maßeinheiten und EDQM für Dosisformen und Einnahmearten.
Diese Spezifikation verwendet das HL7-Template-Austauschformat [1] und ART-DECOR® [www.art-decor.org] als Spezifikationsplattform. Nutzer dieses Leitfadens können die IPS-Projektseite in ART-DECOR® besuchen, um die Template-Spezifikationen zu durchsuchen und Beispiele zu überprüfen.
5.2 Annahmen
Dieser Implementierungsleitfaden wurde von der Arbeitsgruppe unter folgenden Annahmen erstellt:
- Der Leitfaden spezifiziert das "Endprodukt", ein Patient Summary Dokument, das in Österreich allgemein und speziell in ELGA verwendet werden kann und alle Daten und Strukturen enthält, um es auch für den grenzüberschreitenden Austausch von Gesundheitsdaten zu nutzen.
- Die Erstellung des Patient Summary Dokuments wurde bewusst weitgehend ausgeklammert.
- Fragen der Finanzierung der Umsetzung wurden nicht betrachtet.
- Das Patient Summary definiert eine Struktur, die notwendig ist, um Daten elektronisch und automatisch in anderen GDA-IT-Systemen weiterzuverarbeiten, zu aggregieren und zu übersetzen. Die Arbeitsgruppe hat die Vorgaben im Bewusstsein definiert, dass die notwendigen Quelldaten nicht immer vorliegen, und wenn sie vorliegen, nicht immer in der erforderlichen Struktur und Detailgenauigkeit. Das Patient Summary dient als "Leuchtturm", um künftige Dokumentationen entsprechend diesem Mindeststandard anzupassen.
- Der Leitfaden bezieht sich auf die allgemeinen ELGA-Richtlinien für Dokumente (Allgemeiner CDA-Implementierungsleitfaden). Damit werden die Mechanismen für den Austausch, das Dokumentenmanagement und die Darstellung definiert.
- Der Leitfaden nutzt soweit möglich bereits in anderen Leitfäden definierte strukturierte Inhaltselemente ("Templates")
- Die in diesem Leitfaden definierten Templates sollen baugleich in anderen Dokumenten verwendet werden.
- Die Templates werden in Art-Decor unter Nutzung des internationalen Template Standards modelliert, Prüfregeln ("Schematron") können direkt aus Art-Decor abgeleitet werden.
5.3 Umgang mit codierten Informationen und Terminologien
5.3.1 Codierte Information
Eine Prämisse des Patient Summary-Leitfadens ist eine durchgängige Maschinenlesbarkeit der einzelnen medizinischen Informationen. Dazu ist es notwendig, die Informationen mit codierten Konzepten auszudrücken ("Codierung"). Codierte Informationen erlauben eine Übersetzung in andere Sprachen ("Translation") und eine Überführung in andere Terminologien oder Codesysteme ("Transcodierung"). Die Datentypen für codierte Informationen werden in Allgemeiner Leitfaden: Codierte Elemente beschrieben. Wenn die erwünschten Informationen nicht vorliegen oder nicht mit codierten Konzepten ausgedrückt werden können, kommen die im Folgenden vorgestellten Methoden zum Einsatz.
5.3.2 Unbekannte und keine Information
Nicht immer können für bestimmte erwünschte Inhalte (Erkrankungen, Zustände, Eigenschaften, etc.) auch tatsächlich Angaben gemacht werden. Der Leitfaden unterscheidet dabei zwischen zwei Situationen:
- Der erwünschte Inhalt ist unbekannt (z.B. wenn die Medikation eines Patienten unbekannt ist)
- Der erwünschte Inhalt liegt bekanntlich nicht vor (z.B. wenn der Patient tatsächlich keine Medikamente einnimmt)
Spezifischere Formen abwesender Information oder Negation wurden nicht als relevant erachtet, wie zum Beispiel die Abwesenheit einer Allergie auf ein bestimmtes Antigen, der Ausschluss einer bestimmten Krankheit oder die Tatsache, dass eine bestimmte Impfung nicht durchgeführt wurde.
Für die semantische Repräsentation dieser Situationen werden SNOMED-CT-Codes verwendet; die sonst in CDA üblichen Mechanismen (nullFlavor, negationInd) werden hier weitgehend vermieden. So sollen die Inhalte unabhängig von einem bestimmten technischen Standard ausgedrückt werden, die Implementierungen robuster und einfacher gemacht sowie die Transformation in andere Standards wie z.B. FHIR erleichtert werden.
In einigen Fällen fehlen zum Zeitpunkt der Erstellung des Leitfadens die benötigten SNOMED-CT-Konzepte, z. B. "Allergische Disposition nicht bekannt (Situation)". Diese Konzepte wurden bereits beantragt und harren der Aufnahme in eine zukünftige Version von SNOMED CT International Edition. Zwischenzeitlich werden diese Konzepte durch temporäre Platzhalter-Codes dargestellt, die alle mit 'X-' beginnen (z.B. X-AllergicDispositionNotKnown).
5.3.2.1 Darstellung von unbekannter und bekannt fehlender Information im Text
Unbekannte und fehlende Information soll auch im menschenlesbaren Text (section.text) einheitlich dargestellt werden. Folgende Textbausteine sind VERPFLICHTEND zu verwenden:
- Es liegt keine Information über [X] vor (Bedeutung: die Informationen über [X] wurden nicht erhoben, können nicht erhoben werden oder sind nicht verfügbar)
- Keine [X] (Bedeutung: Es gibt tatsächlich keine Informationen über [X] oder [X] liegt nachweislich nicht vor.)
5.3.2.1.1 Anwendungsbeispiele
Es liegt keine Information über Allergien oder Intoleranzen vor:

Es wurden keine Impfungen durchgeführt:

5.3.2.1.2 Codebeispiel für den lesbaren Text
Tabellarische Darstellung gilt auch für unbekannte und fehlende Informationen, zusätzlich soll die Nicht-Information optisch hervorgehoben werden (Stylecode).
<title>Allergien und Intoleranzen</title>
<text>
<table>
<tbody>
<tr ID="al-1">
<td>
<content styleCode="xELGA_blue">Es liegt keine Information über Allergien oder Intoleranzen vor</content>
</td>
</tr>
</tbody>
</table>
</text>
5.3.3 Uncodierte Information
Bei der Erstellung des Dokumentes können möglicherweise bestimmte Informationen vorliegen, die nicht codiert werden können, weil
- die Information nicht mit den im Leitfaden zugelassenen Terminologien (Value Sets) dargestellt werden kann oder
- die Information in keiner bekannten Terminologie enthalten ist, beziehungsweise der Inhalt nicht codiert wurde.
Diese erste Situation wird mit dem folgenden Beispiel verdeutlicht.
<code codeSystem="1.2.40.0.34.5.174" nullFlavor="OTH">
<originalText>
<reference value="#ref1"/>
</originalText>
</code>
Für die Information ist kein geeigneter Code im vorgegebenen Codesystem vorhanden (im Beispiel ICD-10 BMGF 2018). Der konkrete Inhalt wird im Section-Text angegeben und vom Code-Element nur referenziert (value im reference-Element). Diese Variante kann für coding strength CNE (coded no extensions) eingesetzt werden. Der Elementname kann auch anders sein, zB Value.
Hinweis: Mit den zugrunde liegenden Datentypen (HL7 V3 Data Types R1) kann nicht angegeben werden, dass Codes zwar im Codesystem, aber nicht im referenzierten Value Set verfügbar sind. Spätere Versionen dieses Leitfadens können gegebenenfalls auf Data Types R2 aufbauen, um diese Angabe zu unterstützen.
Das folgende Beispiel bezieht sich auf die zweite Situation:
<value xsi:type="CD" nullFlavor="NI">
<originalText>
<reference value="#ref1"/>
</originalText>
</value>
Im zweiten Beispiel wird der allgemeinste NullFlavor "NI" (No Information) verwendet; es gilt sowohl für coding strength CNE (coded no extensions) and CWE (coded with extensions). Wie im ersten Beispiel wird der konkrete Inhalt im Section-Text angegeben und vom Code-Element nur referenziert (value im reference-Element).
Die zweite Variante ist die häufiger eingesetzte Variante.
Hinweis: Der geeignetste NullFlavor wäre eigentlich "UNC" (Uncoded), aber dieser NullFlavor ist in der RIM-Version, auf der HL7 CDA Rel.2 aufbaut, nicht verfügbar. Daher muss der allgemeinere NullFlavor "NI" (No Information) verwendet werden.
5.3.4 Nicht zugeordnete codierte Information
Bei der Erstellung des Dokumentes können möglicherweise bestimmte Informationen codiert in der Quelldokumentation vorliegen, aber die Codes sind nicht in den im Leitfaden zugelassenen Terminologien (Value Sets) verfügbar.
Wenn das codierte Element mit de coding strength CNE (coded no extensions) angegeben ist, wird der nullFlavor "OTH" verwendet; bei coding strength CWE (coded with extensions) der nullFlavor "NI".
<value xsi:type="CD" codeSystem="2.16.840.1.113883.6.96" nullFlavor="OTH">
[
<originalText>
<reference value="#ref1"/>
</originalText>
]
<translation code="A02.9" codeSystem="1.2.40.0.34.5.174"
displayName="Salmonelleninfektion, nicht näher bezeichnet"/>
</value>
Die eckigen Klammern deuten an, dass Elemente optional sind. Hinweis: Mit den zugrunde liegenden Datentpyen (HL7 V3 Data Types R1) kann nicht angegeben werden, dass Codes zwar im Codesystem, aber nicht im referenzierten Value Set verfügbar sind. Spätere Versionen dieses Leitfadens können gegebenenfalls auf Data Types R2 aufbauen, um diese Angabe zu unterstützen.
Im Falle der coding strength CWE (coded with extensions) wird der nullFlavor "NI" vorgeschlagen und ebenso die Angabe des korrekten Codes im <translation>-Teilelement. Dies ermöglicht die Angabe, dass eine Zuordnung zu dem Referenz-Value Set versucht wurde, aber keine geeigneten Zielcodes identifiziert wurden.
<value xsi:type="CD" codeSystem="2.16.840.1.113883.6.96" nullFlavor="NI">
[
<originalText>
<reference value="#ref1"/>
</originalText>
]
<translation code="A02.9" codeSystem="1.2.40.0.34.5.174"
displayName="Salmonelleninfektion, nicht näher bezeichnet"/>
</value>
Die eckigen Klammern deuten an, dass Elemente optional sind.
5.3.5 Zugeordnete codierte Information (Übersetzung)
Es kann vorkommen, dass bestimmte Informationen codiert in der Quelldokumentation vorliegen, aber in einer anderen Terminologie als vom Leitfaden zugelassen. Wenn die codierten Konzepte korrekt von der einen in die andere Terminologie zugeordnet werden können (also "übersetzt" oder "gemappt"), ist es erlaubt, auch die originalen Codes zusätzlich anzugeben.
1. Fall: Ein einzelner lokaler Code wird auf einen Code im Referenz-Value Set gemappt
<value xsi:type="CD" code="42338000" codeSystem="2.16.840.1.113883.6.96"
displayName="Salmonella gastroenteritis">
[
<originalText>
<reference value="#ref1"/>
</originalText>
]
<translation code="003.0" codeSystem="2.16.840.1.113883.6.103"
displayName="Gastroenterite da Salmonella"/>
</value>
Die eckigen Klammern deuten an, dass Elemente optional sind.
2. Fall: Mehrere lokale Codes werden auf das Referenz-Value Set gemappt
<value xsi:type="CD" code="C50.9" codeSystem="1.2.40.0.34.5.171"
codeSystemName="ICD-10 BMGF"
displayName="Bösartige Neubildung: Brustdrüse, nicht näher bezeichnet">
[
<originalText>
<reference value="#problem4name"/>
</originalText>
]
<translation code="code-example" codeSystem="1.999.999"
codeSystemName="this is only an example"
displayName="FEMALE BREAST INFILTRATING DUCTAL CARCINOMA, STAGE 2">
<translation code="174.9" codeSystem="2.16.840.1.113883.6.103"
codeSystemName="ICD-9CM"
displayName="Malignant neoplasm of breast (female), unspecified"/>
<translation code="C50.919" codeSystem="2.16.840.1.113883.6.90"
codeSystemName="ICD-10-CM"
displayName="Malignant neoplasm of unspecified site of unspecified female breast"/>
</translation>
<translation code="422479008" codeSystem="2.16.840.1.113883.6.96"
codeSystemName="SNOMED CT"
displayName="FEMALE BREAST INFILTRATING DUCTAL CARCINOMA, STAGE 2"/>
</translation>
</value>
Die eckigen Klammern deuten an, dass Elemente optional sind.
3. Fall: Ein lokaler Code entstammt derselben Terminologie wie das Referenz-Value Set, besitzt aber eine unterschiedliche Granularität.
<code code="60591-5" codeSystem="2.16.840.1.113883.6.1"
codeSystemName="LOINC" displayName="Patient Summary">
<translation code="60592-3" codeSystem="2.16.840.1.113883.6.1"
displayName="Patient summary unexpected contact"/>
</code>
Hinweis: Die R1 Datentyp-Definition versteht die <translation> nur als Mapping zwischen unterschiedlichen Codesystemen ("a set of other concept descriptors that translate this concept descriptor into other code systems"). Es hat sich aber die Interpretation durchgesetzt, dass auch dasselbe Konzept in mehreren Repräsentationen ausgedrückt werden kann, wie es einige Codesysteme (z.B. SNOMED CT erlauben).
5.4 Mehrsprachigkeit
Codierte Informationen können einfach in unterschiedlichen Sprachen ausgedrückt werden. Für einen zuverlässigen und sicheren grenzüberschreitenden Datenaustausch (EU eHealth Network) ist dies eine funktionelle Notwendigkeit.
Der zugrunde liegende Standard HL7 CDA Rel. 2 hat mit Bordmitteln keine Möglichkeit, um einen Anzeigetext zu einem codierten Konzept in mehreren Sprachen anzugeben. Dieser Leitfaden übernimmt daher als optionales Element die Erweiterung (extension) 'ips:designation', die im HL7 IPS Leitfaden dafür vorgeschlagen wird.
Beispiel 1: Ohne Code-Mapping
<code code="60591-5" codeSystem="2.16.840.1.113883.6.1" codeSystemName="LOINC" displayName="Patient Summary"> <ips:designation lang="it-IT" value="Profilo Sanitario Sintetico"/> <ips:designation lang="fr-FR" value="Patient Summary"/> <ips:designation lang="en" value="Patient Summary"/> </code>
Beispiel 1: Mit Code-Mapping
<value xsi:type="CD" code="42338000" codeSystem="2.16.840.1.113883.6.96"
displayName="Salmonella-gastroenteritis">
<ips:designation lang="da-DK" value=" Salmonella-gastroenteritis"/>
<ips:designation lang="en" value="Salmonella gastroenteritis (disorder)" type="FSN"/>
[
<originalText>
<reference value="#ref1"/>
</originalText>
]
<translation code="003.0" codeSystem="2.16.840.1.113883.6.103"
displayName="Gastroenterite da Salmonella"/>
</value>
Die eckigen Klammern deuten an, dass Elemente optional sind.
5.4.1 Übersetzung des narrativen Textes
Bei einer Übersetzung eines Dokuments muss vor allem der lesbare Text in anderen Sprachen dargestellt werden können. Die Übersetzung muss dazu bereits im Dokument vorhanden sein, wobei die Übersetzung von einer Person durchgeführt werden kann oder aber automatisch aus den maschinenlesbaren Elementen abgeleitet werden kann. Bei der Darstellung muss (a) die Sprache der Ausgabe identifiziert werden und (b) angegeben werden, ob es sich um das Original handelt oder die Übersetzung. Außerdem sollte die Quelle (Freitext, maschinenlesbare Elemente) und Art der Übersetzung (Übersetzer, automatisch, etc.) angegeben werden.
Die hier verwendete Methode enthält das Original im <text>-Element der Section und die optionalen Übersetzungen in einem <text>-Element einer Subsection, wobei pro Übersetzung eine Subsection angegeben wird. (specified in template 2.16.840.1.113883.10.22.3.15)
Beispiel:
<section>
<templateId root="2.16.840.1.113883.3.1937.777.13.10.5"/>
<id root="..." extension="..."/>
<code code="48765-2" codeSystem="2.16.840.1.113883.6.1"
displayName="Allergies and adverse reactions"/>
<title>Allergies and Intolerances</title>
<text>No known Allergies</text>
<!-- omissions -->
<component>
<section>
<!-- subordinate section carrying a translation of the parent section -->
<title>Allergie ed Intolleranze</title>
<text>Nessuna Allergia Nota</text>
<languageCode code="it-IT"/>
</section>
</component>
</section>
5.5 Herkunft der Information
Die Angabe der Quelle einer Information kann für die klinische Bewertung dieser Information maßgeblich sein, besonders wenn ein Dokument aus mehreren Quellen (automatisch) zusammengestellt wurde. Daher erlaubt dieser Leitfaden eine systematische und durchgängige Angabe der Herkunft der elektronischen Daten.
5.5.1 Herkunftsangabe auf Dokument-Ebene
Der Autor des Patient Summary-Dokuments MUSS verpflichtend im Header angegeben werden. Dabei kann es sich um eine Person ("human curated") oder um eine Software ("software assembled") handeln.
5.5.2 Herkunftsangabe auf Section-Ebene
Für jeden Dokumentationsabschnitt (Section) können jeweils mehrere Autoren und Informanten angegeben werden. Da die Zuordnung der Einzelinformation bei Angabe mehrerer Autoren und Informanten uneindeutig ist, wird empfohlen, die Herkunft auf Entry-Ebene anzugeben.
- Autor (Gesundheits-Fachperson, die die Information erstellt hat mit Name und Organisation).
- Informant (Person, auf deren Angabe die Information beruht: der Patient selbst oder eine dem Patienten verwandte oder bekannte Person)
5.5.3 Herkunftsangabe auf Entry-Ebene
- Autor (Gesundheits-Fachperson, die die Information erstellt hat mit Name und Organisation)
- Informant (Person, auf deren Angabe die Information beruht: der Patient selbst oder eine dem Patienten verwandte oder bekannte Person)
- Dokumentverweis (externalDocument): für jedes Entry kann eine ID angegeben werden, die auf ein externes Dokument verweist, aus dem die Information stammt.
5.6 Zeitangaben
Gemäß Allgemeinem CDA-Leitfaden dürfen Zeitpunkte nur auf zweierlei Arten angegeben werden:
- Datum im Format YYYYMMDD
- Datum und Uhrzeit mit Zeitzone im Format YYYYMMDDhhmmss[+/-]HHMM
Ist nur eine eine weniger genaue Zeitangabe verfügbar, sind die fehlenden Stellen mit der Ziffer Null aufzufüllen. Also zum Beispiel ist für "September 2017" die Zeichenfolge 20170900 anzugeben. Die HL7 V3 Datentypen interpretieren Datumswerte so, als ob alle möglichen, aber nicht angegebenen Stellen mit 0 befüllt wären.
Achtung bei Zeitintervallen: Ein Datum, das mit yyyymmdd angegeben wurde, wird standardgemäß interpretiert als yyyymmdd000000 – also der Tag um 0:00:00 Uhr. Wenn also als Zeitraum z.B.: der ganze 1. Dezember 2017 angegeben werden soll, MUSS das so erfolgen:
<low value="20171201"/> <high value="20171202"/>
Für mehr Klarheit empfiehlt sich daher die zusätzliche Angabe der Zeit mit Zeitzone:
<low value="20171201000000+0100"/> <high value="20171201235959+0100"/>
6 Anhang
6.1 Tabellen
6.2 Abbildungen
- ↑ Zusammenspiel der Implementierungsleitfäden
6.3 Glossar
ToDo...
6.4 Referenzen
6.5 Revisionsliste
Diese Erstversion ist erst im Entstehen. Änderungen können Sie in der Versionsgeschichte dieser Seite einsehen.
6.6 Impressum
Medieneigentümer, Herausgeber, Hersteller, Verleger:
ELGA GmbH, Treustraße 35-43, Wien Österreich
Geschäftsführer: DI Dr. Günter Rauchegger, Dr. Franz Leisch
Email: cda@elga.gv.at
Redaktion, Projektleitung, Koordination:
Mag. Dr. Stefan Sabutsch, stefan.sabutsch@elga.gv.at
Abbildungen: © ELGA GmbH
Nutzung: Das Dokument enthält geistiges Eigentum der Health Level Seven Int. und HL7 Austria, Eggenberger Allee 11, 8020 Graz; www.hl7.at. Die Nutzung ist zum Zweck der Erstellung medizinischer Dokumente ohne Lizenz- und Nutzungsgebühren ausdrücklich erlaubt. Andere Arten der Nutzung und auch auszugsweise Wiedergabe bedürfen der Genehmigung des Medieneigentümers.
Wien, im Dezember 2017
Download unter wiki.hl7.at